
乙醇分子可能存在CH3CH2OH和CH3OCH3两种结构。能够证明乙醇(分子式C2H6O)的结构是CH3CH2OH的最充分的理由是( )
A.23g乙醇与足量的金属钠反应,可以放出0.25mol氢气
B.1mol乙醇充分燃烧生成2molCO2和3molH2O,消耗3molO2
C.乙醇的沸点高于乙烷
D.1mol乙醇氧化后生成1mol乙醛
科目:高中化学 来源:2016-2017学年山东省高二上开学测化学试卷(解析版) 题型:选择题
下列说法正确的是
A. I的原子半径大于Br,HI比HBr的热稳定性强
B. P的非金属性强于Si,H3PO4比H2SiO3的酸性强
C. Al2O3和MgO均可与NaOH溶液反应
D. SO2和SO3混合气体通入Ba(NO3)2溶液可得到BaSO3和BaSO4
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南省高二上开学测化学试卷(解析版) 题型:选择题
将4molA气体和2molB气体在2L的容器中混合,并在一定条件下发生反应2A(g)+B(g)  2C(g),若经2s后测得C的浓度为0.6mol·L-1,下列几种说法不正确的是( )
2C(g),若经2s后测得C的浓度为0.6mol·L-1,下列几种说法不正确的是( )
①用物质A表示的平均反应速率为0.3mol·L-1·s-1
②用物质B表示的平均反应速率为0.6mol·L-1·s-1
③2s时物质A的转化率为70% ④2s时物质B的浓度为0.7mol·L-1
A.①③ B.①④ C.②③ D.③④
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省高二上开学测化学试卷(解析版) 题型:填空题
盐酸、硫酸和硝酸是中学阶段常见的“三大酸”。现就三大酸与金属铜反应的情况,回答下列问题:
(1)稀盐酸不与Cu 反应,若在稀盐酸中加入H2O2后,则可使铜顺利溶解。该反应的化学方程式为:___________________。
(2)在一定体积的10mol/L的浓硫酸中加入过量铜片,加热使之反应,被还原的硫酸为0.9mol。则浓硫酸的实际体积__________(填“大于”、“ 等于”或“小于”)180mL。若使剩余的铜片继续溶解,可在其中加入硝酸盐溶液(如KNO3溶液),则该反应的离子方程式为________________。
(3)镁铁混合物4.9g,溶解在过量的某浓度的稀硝酸中,完全反应后得到标准状况下2 .24LNO气体。若向反应后的溶液中加入足量的烧碱,则可生成沉淀的质量是____________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省高二上开学测化学试卷(解析版) 题型:选择题
一种新型的乙醇电池,它用磺酸类质子溶剂.电池总反应为:C2H5OH+3O2=2CO2+3H2O, 电池示意如图,下列说法正确的是( )

A.A处通氧气,B处通乙醇
B.电池工作时电子由a极沿导线经灯泡再到b极
C.电池正极的电极反应为:O2+2H2O+4e-=4OH-
D.若用这种电池作电源保护金属铁,则a电极连接石墨,b连接铁
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省高二上开学测化学试卷(解析版) 题型:选择题
往含I-和Cl-的稀溶液中滴入AgN03溶液,沉淀的质量与加入AgN03溶液体积的关系如右图所示。则原溶液中c(I-)/c(Cl-)的比值为( )

A.(V2-V1)/V1 B.V1/V2 C.V1/(V2-V1) C.V2/V1
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省高二上开学测化学试卷(解析版) 题型:选择题
下列各组气体,经充分反应后,原来的气体有剩余的是 ( )
A.1molNH3和1molHCl混合
B.1molNO和0.5molO2混合
C.1molSO2和1molH2S混合
D.等体积的NO和NO2被足量烧碱溶液吸收
查看答案和解析>>
科目:高中化学 来源:2016-2017学年辽宁省高二上开学测化学试卷(解析版) 题型:选择题
如图所示,a、b、c、d均为非金属单质,d、e均为含有10个电子的共价化合物,且分子中所含原子个数:d>e,f为离子化合物,则下列说法错误的是( )
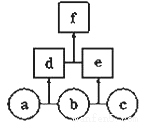
A.常温下,单质a呈气态 B.单质c具有强氧化性
C.稳定性:d>e D.f受热易分解为d和e
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖南省高二上第二次月考化学试卷(解析版) 题型:实验题
工业上通过电解MnSO4和ZnSO4制取Zn和MnO2,原料为软锰矿和闪锌矿,软锰矿中含MnO2约a%,SiO2约20%,Al2O3约4%,其余为水分,闪锌矿中含ZnS约80%,FeS、CuS、SiO2共约7%,其余为水分。
I.(1)为了测量软锰矿中MnO2含量的测定,现将14. 5g软锰矿溶于足量的稀硫酸中,加入足量的碘化钾晶体,充分反应后,过滤,将滤液加水稀释至1L,取25.00ml该溶液于锥形瓶中,滴入几滴淀粉溶液作指示剂,用0. l000mol.L-1的标准Na2S2O3溶液滴定,消耗标准液50. 00mL,则软锰矿中MnO2含量_________。(己知:2KI+2 H2SO4+ MnO2=I2+2H2O+MnSO4+K2SO4;I2+2 S2O32-=2I-+ S4O62-)
II.研宄人员开发了综合利用这两种资源的同槽酸浸工艺,工艺流程如图l所示.
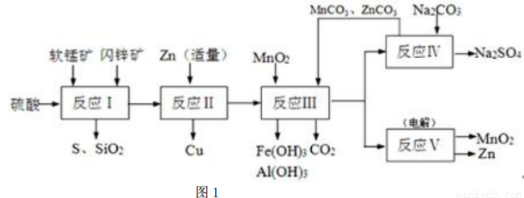
请回答下列问题:
(2)反应I的滤液中含有MnSO4、ZnSO4、CuSO4、Fe2(SO4)3、Al2 (SO4)3等,试完成反应I中生成CuSO4和MnSO4的化学方程MnO2+CuS+___________=________+_________+CuSO4+MnSO4.
(3)反应II加入适量锌的作用是___________;如果锌过量,还会进一步发生反应的离子方程式为_____________。
(4)图2是Na2SO4和Na2SO4·10H2O的溶解度曲线(g/l00g水),则Ⅳ中得到Na2SO4固体的操作是:将分离出MnCO3和ZnCO3后的滤液升温结晶→___________→用乙醇洗涤→干燥,用乙醇洗涤而不用水洗的原因是__________________________。

(5)用惰性电极电解MnSO4和ZnSO4制得Zn和MnO2的总反应是_______________________。
(6)本工艺可以循环利用的物质除MnO2、MnCO3、ZnCO3以外,还有___________(写化学式).
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com