
(15分)A、B、C、D、E、F六种元素,A、B、C属于第四周期元素且单质均为固体,原子处于基态时A、B原子核外电子均成对,且核电荷数A>B;C与A在周期表属于同一区的元素,如图是金属B和C所形成的某种合金的晶胞结构示意图;D、E、F均位于p区,D原子在基态时p轨道半充满且电负性是同族元素中最大的;E、F的原子均有三个能层,E原子的第一至第四电离能(kj/mol)分别为:578、1817、2745、ll575;E与F能形成原子数目比为1:3、熔点为190℃的化合物Q

(1)写出A的基态核外电子排布式 ;用最简式表示B、C形成合金的组成
(用B、C元素符号表示)。该合金的密度为 a g/cm3,其晶胞的边长为 。
(2)C2+和A2+都能与NH3、H20等形成配位数为4的配合物。[A(NH3)4]2+和[C(NH3)4]2+空间构型不同且都具有对称性,则[C(NH3)4]2+的空间构型为 。[A(NH3)4]2+中A原子轨道的杂化方式为 。
(3) 含有D、碳、硫三种元素的负一价离子中,所有原子均满足最外层8电子结构,一个电子是由硫原子所得,则其电子式为 。
(4)实验测得气态无水Q在1.Ol×105 Pa、t1℃的密度为5.OO g·L-1、气体摩尔体积为53.4 L·mol-,则此时Q的组成为(写化学式) ,
(1)1s22s22p63s23p63d104s2或[Ar]3d104s2
CaCu5 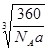 cm(3分) (2)平面正方形
sp3 (3)
cm(3分) (2)平面正方形
sp3 (3)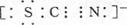 (4)A12C16
(4)A12C16
【解析】根据A、B原子核外电子均成对,且核电荷数A>B,所以A是锌,B是钙。C与A在周期表属于同一区的元素,且二者位于同一周期,所以C是铜。D原子在基态时p轨道半充满且电负性是同族元素中最大的,所以D是氮元素。EF属于第三周期,根据E的电离能可知,E是铝元素。E与F能形成原子数目 比为1:3、熔点为190℃的化合物Q,所以F是氯元素。
(1)根据晶胞的结构图可知,含有的钙原子数是8×1/8=1,铜原子是8×1/2+1=5,所以化学式为CaCu5。设边长为x,则x3×a g/cm3=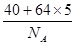 ,解得x=
,解得x=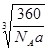 cm。
cm。
(2)[A(NH3)4]2+和[C(NH3)4]2+空间构型不同且都具有对称性,说明[C(NH3)4]2+的空间构型是平面正方形,[A(NH3)4]2+是正四面体型结构,所以是sp3杂化。
(3)所有原子均满足最外层8电子结构,所以氮和碳形成的是三键,因此电子数为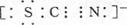 。
。
(4)根据密度和气体的摩尔体积可知,Q的相对分子质量是53.4×5.00=267,所以化学式为A12C16。


科目:高中化学 来源:2012届山东省微山一中高三第二次质量检测化学试卷 题型:填空题
(15分)A、B、C均为中学化学常见的单质,其中一种是金属,通常状况下,A为固体,B为黄绿色气体,C为气体,其余均为化合物,X是一种常用的具有挥发性的无氧强酸,E为黑色固体,H为无色液体,它们之间的转化关系如图(其中某些反应条件和产物已略去)。
(1)写出:A的化学式 ,F的化学式 。
(2)在反应①~⑦中,不属于氧化还原反应的是 (填序号)。
(3)完成:E和X反应的离子方程式: ;
(4)完成H和某种化合物快速制C的化学方程式 
 ,每生成0.15molC电子转移 mol。
,每生成0.15molC电子转移 mol。
(5)B蒸气与过量氨气混合有白烟及另一种气体单质产生,该反应的化学方程式为:
。
查看答案和解析>>
科目:高中化学 来源:2010-2011学年辽宁省高三下学期模拟考试(理综)化学部分 题型:填空题
(15分)A、B、C、D、E五种短周期元素,原子序数依次增大,A、E同主族,A元素的原子半径最小,B元素原子的最外层电子数是内层电子数的2倍,C元素的最高价氧化物的水化物X与其氢化物反应生成一种盐Y,A、B、C、E四种元素都能与D元素形成原子个数比不相同的常见化合物.回答下列问题:
⑴常温下,X、Y的水溶液的pH均为5.则两种水溶液中由水电离出的H+浓度之比是 .
⑵A、B、D、E四种元素组成的某无机化合物,受热易分解。写出少量该化合物溶液与足量的Ba(OH)2溶液反应的离子方程式 .
⑶A、B、D、E四种元素组成的某无机化合物浓度为0.1 mol/L时,pH最接近 .
A.5.6 B.7.0 C.8.4 D.13.0
⑷在一个装有可移动活塞的容器中进行如下反应:C2(g)+3A2(g) 2CA3(g)
2CA3(g)
ΔH=-92.4 kJ·mol-1.反应达到平衡后,测得容器中含有C2 0.5mol,A2 0.2mol,CA3 0.2 mol,总容积为1.0 L.
①如果达成此平衡前各物质起始的量有以下几种可能,其中不合理的是________:
A.C2 0.6mol,A2 0.5mol,CA3 0mol
B.C2 0mol,A2 0mol,CA3 1.2mol
C.C2 0.6mol/L,A2 0.5mol/L,CA3 0.2mol/L
②求算此平衡体系的平衡常数K=________;
③如果保持温度和压强不变,向上述平衡体系中加入0.18molC2,平衡将________(填“正向”、“逆向”或“不”)移动.理由是
.
④已知0.4mol 液态C2 A4与足量的液态双氧水反应,生成C2和水蒸气,放出256.65 kJ
的热量.写出该反应的热化学方程式 .
查看答案和解析>>
科目:高中化学 来源:2014届天津市高一上学期期末考试化学试卷 题型:填空题
(15分)A、B、C、D均为中学所学的常见物质且均含有同一种元素,它们之间的转化关系如下图所示(反应条件及其他物质已经略去):
A B
B C
C D
D
(1)若A、D的水溶液均能使湿润的蓝色石蕊试纸变红,则A、D分别为(填写化学式)。
A ,D 。
(2)若A的水溶液能使湿润的红色石蕊试纸变蓝,D的稀溶液能使蓝色的湿润石蕊试纸变红,则A为
。写出A B转化的化学方程式:
。
B转化的化学方程式:
。
(3)若A为活泼金属元素的单质,D为强碱,焰色反应显黄色,则A是 ,
B是 ,C是 。C可作为呼吸面具的填充剂,C与二氧化碳发生反应的化学方程式为: 。A跟水发生反应的化学方程式 。
(4)若A为常见的非金属单质,则A有多种情况,请填写下表,并完成相应的化学反应方程式。(可以不填满,也可以补充)
|
编号 |
A |
· B—C化学方程式 |
|
① |
|
|
|
② |
|
|
|
③ |
|
|
查看答案和解析>>
科目:高中化学 来源:2010年河南郑州四中高考押题卷理综化学试题 题型:填空题
(15分)A、B、C、D都是中学化学中常见物质,其中A、B、C均含有同一种元素,在一定条件下相互转化关系如图所示(部分产物省略)。请按要求回答下列问题:

(1) 若A是氯碱工业的一种重要产品,通常状况下D是一种非极性气体分子,则D的结构式为 ,A与D以物质的量3:2反应后的溶液中离子浓度的大小顺序为:
(2) 若D为某金属单质,向C的溶液中滴加AgNO3溶液,产生不溶于稀硝酸的白色沉淀,则B的化学式为 ;将B的溶液加热蒸干再灼烧,所得固体物质的化学式为 。
(3) 若D为强电解质溶液,A和C在溶液中反应生成白色沉淀B,则A和C反应的离子方程式为 ;符合此条件的D物质可能是 (填序号)
A.H2SO4 B.CH3COOH C. NaOH D.NH3·H2O E.BaCl2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com