
3HNO2====2NO↑+HNO3+H2O
从浓醋酸、氨水、纯碱、稀盐酸、碘化钾淀粉溶液中选择适当的物质作试剂,用两种简单的化学实验鉴别亚硝酸钠和氯化钠。试写出两种实验方法使用的试剂,并据此鉴别它们的现象。
(1)方法一(只用一种试剂)
试剂:____________,现象:_________________________________________。
(2)方法二
试剂:____________,现象:_________________________________________。
科目:高中化学 来源: 题型:阅读理解
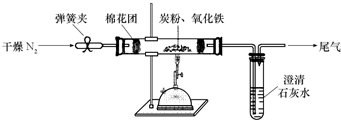
| ||
| ||

查看答案和解析>>
科目:高中化学 来源: 题型:
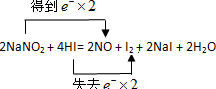

查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解

| ||
| ||
| ||
| △ |
| ||
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com