
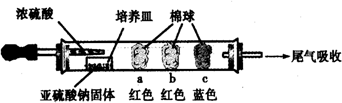
| 棉球 | 棉球上滴加的试剂 | 实验现象 | 解释和结论 |
| a | 品红试液 | 棉球变白,微热后又恢复红色 | SO2具有漂白性,且为暂时性漂白 |
| b | 含酚酞的NaOH溶液 | 棉球变为白色 | 离子方程式:2OHˉ+SO2 =SO32ˉ+H2O或OHˉ+SO2=HSO3ˉ |
| c | 含淀粉的碘水 | 棉球变为白色 | 该气体具有还原性 (选填“氧化性”或“还原性”) |
分析 I.a二氧化硫具有漂白性,但其漂白性不稳定,加热时会恢复为原来的颜色;
b.二氧化硫属于酸性氧化物,能和强碱反应生成盐和水;
c.二氧化硫具有还原性,能和碘发生氧化还原反应;
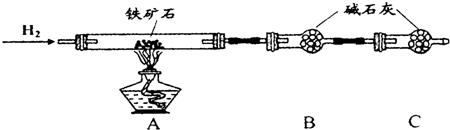
II.实验一:铁矿石中含氧量的测定
(3)在氢气还原金属氧化物时,在点燃酒精灯前要验纯;
(5)反应后装置B增重1.35g,即氢气和氧化铁反应后固体质量的增加值,可以根据差量法来计算;
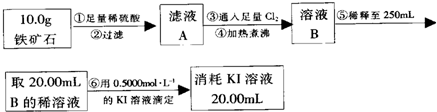
实验二:(1)根据过滤、稀释液体和配制一定体积的溶液所选择的仪器来回答;
(2)根据滴定实验以及滴定过程中的实验误差分析知识判断;
根据碘元素计算铁元素的质量分数,再根据铁元素质量分数和氧元素质量分数计算出铁的氧化物的化学式.
解答 解:I.a.红色棉球变白,微热后又恢复红色,说明二氧化硫使品红溶液褪色,则棉球上滴有品红溶液,该实验说明二氧化硫具有漂白性,但其漂白性不稳定,
b.二氧化硫属于酸性氧化物,能和NaOH溶液反应生成亚硫酸钠和水或亚硫酸氢钠,导致溶液碱性减弱,所以棉球变为白色,离子方程式为:SO2+2OH-=SO32-+H2O或OHˉ+SO2=HSO3ˉ
c.碘遇淀粉试液变蓝色,二氧化硫具有还原性,碘具有氧化性,二者反应生成氢碘酸和硫酸,所以棉球变为白色,离子方程式为:SO2+I2+2H2O=4H++SO42-+2I-,该实验说明二氧化硫具有还原性,
故答案为:
| 棉球 | 棉球上滴加的试剂 | 现象 | 解释和结论 |
| a | 品红试液 | SO2具有漂白性,且为暂时性漂白 | |
| b | 离子方程式:2OHˉ+SO2 =SO32ˉ+H2O或OHˉ+SO2=HSO3ˉ | ||
| c | 含淀粉的碘水 | 还原 性 |
点评 本题考查了探究铁矿石中铁和氧元素的含量、二氧化硫的性质,二氧化硫具有还原性、氧化性、漂白性,根据二氧化硫的这几个性质分析解答;铁矿石中成分及其含量的测定中,根据物质的形成从整体上把握知识点,同时考查学生分析问题、解决问题的能力,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 制备氢氧化铁胶体:向沸腾的NaOH溶液中,滴加氯化铁饱和溶液,煮沸至红褐色 | |
| B. | 提纯含少量苯酚的苯:加入氢氧化钠溶液,振荡后静置分液,并除去有机相的水 | |
| C. | 检验亚硫酸钠是否变质:将试样溶解后加入氯化钡溶液,观察实验现象 | |
| D. | 比较铁与铜的活泼性:将铜粉加入1.0 mol•L-1 Fe2(SO4)3溶液中,观察实验现象 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
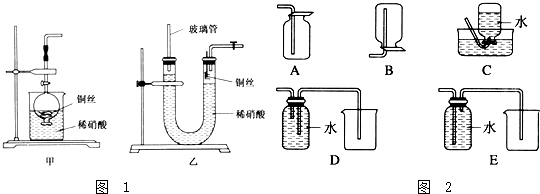
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
| 离子 | Fe2+ | Cu2+ | Mg2+ |
| pH | 7.6 | 5.2 | 10.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
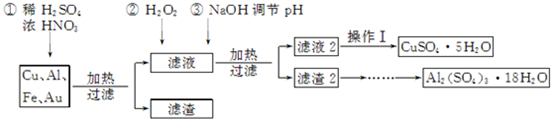
| 温度(K) | 失重(%) | |
| 第一阶段 | 323~523 | 40.54 |
| 第二阶段 | 553~687 | 48.65 |
| 第三阶段 | 1 043以上 | 84.68 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 Na2CO3和NaHCO3是两种常见的钠盐.
Na2CO3和NaHCO3是两种常见的钠盐.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
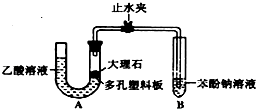 某校学生小组为探究乙酸、碳酸和苯酚的酸性强弱并证明乙酸为弱酸,进行下述实验.
某校学生小组为探究乙酸、碳酸和苯酚的酸性强弱并证明乙酸为弱酸,进行下述实验.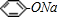 溶液
溶液查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com