
分析 (1)工厂排放的SO2尾气用饱和Na2SO3溶液吸收可得到重要化工原料NaHSO3,正盐转化为酸式盐;
(2)澄清石灰水通入过量CO2生成碳酸氢钙和水,过量的二氧化碳通入偏铝酸钠溶液中,产生白色沉淀氢氧化铝和碳酸氢钠;
(3)工业上,以氨气为原料生产硝酸的第一步为氨催化氧化,氨的催化氧化生成NO和H2O.
解答 解:(1)SO2用饱和Na2SO3溶液吸收,亚硫酸钠和水和二氧化硫反应生成NaHSO3,反应的化学方程式为:SO2+Na2SO3+H2O=2NaHSO3,
故答案为:SO2+Na2SO3+H2O=2NaHSO3;
(2)澄清石灰水通入过量的CO2,过量的CO2与澄清石灰水反应生成HCO3-,反应的离子方程式为CO2+OH-═HCO3-,过量的二氧化碳通入偏铝酸钠溶液中,产生白色沉淀氢氧化铝和碳酸氢钠,反应的离子方程式为:CO2+AlO2-+2H2O=Al(OH)3↓+HCO3-;
故答案为:CO2+OH-═HCO3-;CO2+AlO2-+2H2O=Al(OH)3↓+HCO3-;
(3)工业上氨气被催化氧化生成NO和H2O,化学方程式为:4NH3+5O2$\frac{\underline{\;催化剂\;}}{高温}$4NO+6H2O,故答案为:4NH3+5O2$\frac{\underline{\;催化剂\;}}{高温}$4NO+6H2O.
点评 本题考查了方程式书写,掌握物质性质是解答关键,注意反应物量的不同产物不同,为易错点,题目难度不大.


科目:高中化学 来源: 题型:解答题

 ,该反应类型为取代反应.
,该反应类型为取代反应. .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 根据分散系的稳定性将其分为胶体、溶液和浊液 | |
| B. | 根据化合物在溶液中能否电离将其分为强电解质和弱电解质 | |
| C. | 根据酸分子中含有的氢原子个数将酸分为一元酸、二元酸和多元酸 | |
| D. | 根据反应中是否有电子转移将化学反应分为氧化还原反应和非氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 化学和环境保护、食品营养、材料应用等密切相关.
化学和环境保护、食品营养、材料应用等密切相关. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某实验小组设计了如图所示的甲醇燃料电池装置.
某实验小组设计了如图所示的甲醇燃料电池装置.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
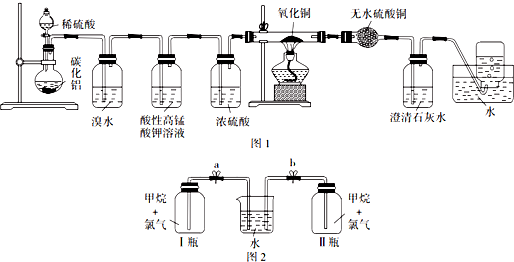
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com