
【题目】下列各项中的两种物质不论以何种比例混合,只要混合物的总物质的量一定,则完全燃烧消耗O2的质量保持不变的是
A.C3H6、C2H4 B.C2H6、C2H6O C.C2H4、C2H6O D.C3H4、C2H6O
科目:高中化学 来源: 题型:
【题目】黄铜灰渣(含有Cu、Zn、CuO、ZnO及少量的FeO、Fe2O3)生产氯化铜晶体的流程如下:

(1)反应Ⅰ中所加Zn粉不能过量的原因是______________________
(2)滤液Ⅱ中含有的主要金属阳离子是___________________
(3)写出反应Ⅱ的化学方程式____________________________________________________
(4)“系列操作”包括蒸发浓缩、冷却结晶、过滤、__________、___________。
(5)在空气中直接加热CuCl2·xH2O晶体得不到纯的无水CuCl2,原因是___________________________________________________(用化学方程式表示)
(6)CuCl2·xH2O晶体中x值的测定:称取3.420g产品溶解于适量水中,向其中加入含AgNO3 4.400×10-2mol的AgNO3溶液(溶液中除Cl- 外,不含其它与Ag+反应的离子),待Cl- 完全沉淀后,用含Fe3+的溶液作指示剂,用0.2000 mol·L-1的KSCN标准溶液滴定剩余的AgNO3。使剩余的Ag+以AgSCN白色沉淀的形式析出。
①滴定终点的现象是_______________________________________。
②若滴定过程用去上述浓度的KSCN标准溶液20.00mL,则CuCl2·xH2O中x值为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量纯净的氨基甲酸铵(NH2COONH4)置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s)![]() 2NH3(g)+CO2(g)。下列可以判断该分解反应已经达到化学平衡状态的是( )
2NH3(g)+CO2(g)。下列可以判断该分解反应已经达到化学平衡状态的是( )
A. v(NH3)=2v(CO2) B. 密闭容器中混合气体的平均摩尔质量不变
C. 密闭容器中混合气体密度不变 D. 密闭容器中氨气的体积分数不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】北京时间2011年11月3日1时43分,中国自行研制的“神舟八号”飞船与“天宫一号”目标飞行器在距地球343公里的轨道成功对接,为建设空间站迈出关键一步。据悉,所用的动力燃料为N2O4和偏二甲肼[(CH3)2NNH2],下列描述不正确的是
A.偏二甲肼的结构简式可以表达为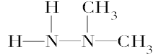
B.偏二甲肼中N元素均为-2价
C. 为偏二甲肼唯一的一种同分异构体
为偏二甲肼唯一的一种同分异构体
D.偏二甲肼与四氧化二氮反应的化学方程式为:(CH3)2NNH2+2N2O4→2CO2+4H2O+3N2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】废气中的H2S通过高温热分解可制取氢气:2H2S(g)![]() 2H2(g)+S2(g)。现在3L密闭容器中,控制不同温度进行H2S分解实验。
2H2(g)+S2(g)。现在3L密闭容器中,控制不同温度进行H2S分解实验。
(1)某温度时,测得反应体系中有气体1.3lmol,反应1 min后,测得气体为l.37mol,则tmin 内H2的生成速率为___________。
(2)某温度时,H2S的转化率达到最大值的依据是_____________(选填编号)。
a.气体的压强不发生变化 b.气体的密度不发生变化
c.![]() 不发生变化 d.单位时间里分解的H2S和生成的H2一样多
不发生变化 d.单位时间里分解的H2S和生成的H2一样多
(3)实验结果如下图。图中曲线a表示H2S的平衡转化率与温度关系,曲线b表示不同温度下、反应经过相同时间且未达到化学平衡时H2S的转化率。该反应为_____反应(填“放热”或“吸热”)。曲线b随温度的升高,向曲线a通近的原因是_________。在容器体积不变的情况下,如果要提高H2的体积分数,可采取的一种措施是________。

(4)使1LH2S与20L空气(空气中O2体积分数为0.2)完全反应后恢复到室温,混合气体的体积是______L 。若2gH2S完全燃烧后生成二氧化硫和水蒸气,同时放出29.4 kJ的热量,该反应的热化学方程式是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化合物的结构(键线式)及球棍模型如下:
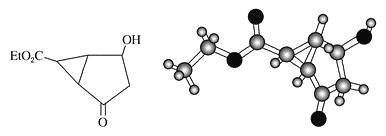
该有机分子的核磁共振氢谱图如下(单位是ppm)。
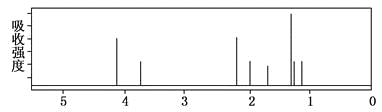
下列关于该有机物的叙述不正确的是
A. 该有机物不同化学环境的氢原子有8种
B. 该有机物与氢氧化钠的醇溶液共热时可以发生消去反应
C. 键线式中的Et代表的基团为—CH2CH3
D. 1mol该有机物最多可以与2mol NaOH反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原电池原理的发现是储能和供能技术的巨大进步,是化学对人类的一项重大贡献。
(1)现有如下两个反应:A.NaOH+HCl===NaCl+H2O;B.Zn+H2SO4===ZnSO4+H2↑。
判断能否设计成原电池A__________,B__________(填“能”或“不能”)。
(2)将纯锌片和纯铜片按图方式插入100 mL相同浓度的稀硫酸中一段时间,回答下列问题:
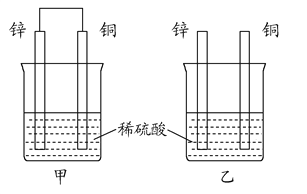
①下列说法正确的是__________。
A.甲、乙均为化学能转变为电能的装置
B.乙中铜片上没有明显变化
C.甲中铜片质量减少、乙中锌片质量减少
D.两烧杯中溶液的pH均增大
②在相同时间内,两烧杯中产生气泡的速度:甲__________乙(填“>”、“<”或“=”)。
③请写出图中构成原电池的负极电极反应式: ____________。
④当乙中产生1.12 L(标准状况)气体时,将锌、铜片取出,再将烧杯中的溶液稀释至1 L,测得溶液中c(H+)=0.1 mol·L-1(设反应前后溶液体积不变)。试确定原稀硫酸的物质的量浓度为__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com