
【题目】下列说法不正确的是( )
A. ![]() 的盐酸中
的盐酸中![]()
B. 将![]() 溶液从常温加热至
溶液从常温加热至![]() ,溶液的
,溶液的![]() 变小但仍保持中性
变小但仍保持中性
C. 常温下,![]() 溶液呈碱性,说明
溶液呈碱性,说明![]() 是弱电解质
是弱电解质
D. 常温下,![]() 为3的醋酸溶液中加入醋酸钠固体,溶液
为3的醋酸溶液中加入醋酸钠固体,溶液![]() 增大
增大
【答案】A
【解析】
A. 盐酸的浓度为2.0×10-7 mol/L,完全电离,接近中性,溶剂水电离出的氢离子浓度的数量级与溶质HCl电离的氢离子浓度相差不大,则计算中氢离子浓度时,不能忽略水中的氢离子浓度,其数值应大于2.0×10-7 mol/L,故A错误;
B. KCl溶液为中性溶液,常温下pH=7,加热到80![]() 时,水的离子积Kw增大,对应溶液的氢离子浓度随温度升高会增大,pH会减小,但溶液溶质仍为KCl,则仍呈中性,故B正确;
时,水的离子积Kw增大,对应溶液的氢离子浓度随温度升高会增大,pH会减小,但溶液溶质仍为KCl,则仍呈中性,故B正确;
C. NaCN溶液显碱性,说明该溶质为弱酸强碱盐,即CN-对应的酸HCN为弱电解质,故C正确;
D. 醋酸在溶液中会发生电离平衡:CH3COOH![]() CH3COO-+H+,向溶液中加入醋酸钠固体,根据同离子效应可知,该平衡会向生成弱电解质的方向(逆向)移动,使溶液中的氢离子浓度减小,pH增大,故D正确;
CH3COO-+H+,向溶液中加入醋酸钠固体,根据同离子效应可知,该平衡会向生成弱电解质的方向(逆向)移动,使溶液中的氢离子浓度减小,pH增大,故D正确;
答案选A。


 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案科目:高中化学 来源: 题型:
【题目】钒(23V)是我国的丰产元素,广泛用于催化及钢铁工业。回答下列问题:
(1)钒在元素周期表中的位置为_______,其价层电子排布图为____________。
(2)钒的某种氧化物的晶胞结构如图1所示。晶胞中实际拥有的阴、阳离子个数分别为____、_____。
(3)V2O5常用作SO2转化为SO3的催化剂。SO2分子中S原子价层电子对数是__对,分子的立体构型为___;SO3气态为单分子,该分子中S原子的杂化轨道类型为____;SO3的三聚体环状结构如图2所示,该结构中S原子的杂化轨道类型为___;该结构中S—O键长有两类,一类键长约140pm,另一类键长约为160pm,较短的键为__(填图2中字母),该分子中含有___个σ键。

(4)V2O5溶解在NaOH溶液中,可得到钒酸钠(Na3VO4),该盐阴离子的立体构型为___;也可以得到偏钒酸钠,其阴离子呈如图3所示的无限链状结构,则偏钒酸钠的化学式为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列热化学方程式:
Zn(s)+![]() O2(g)=ZnO(s) ΔH1=-351.1kJ·mol-1
O2(g)=ZnO(s) ΔH1=-351.1kJ·mol-1
Hg(l)+![]() O2(g)=HgO(s) ΔH2=-90.7kJ·mol-1
O2(g)=HgO(s) ΔH2=-90.7kJ·mol-1
由此可知Zn(s)+HgO(s)=ZnO(s)+Hg(l) ΔH3,其中ΔH3的值是( )
A.-441.8kJ·mol-1B.-254.6kJ·mol-1
C.-438.9kJ·mol-1D.-260.4kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】动手实践:某同学做同周期元素性质递变规律实验时,自己设计了一套实验方案,并记录了有关实验现象(见下表,表中的“实验方案”与“实验现象”前后不一定是对应关系)。
实验步骤 | 实验现象 |
①将镁条用砂纸打磨后,放入试管中,加入少量水后,加热至水沸腾;再向溶液中滴加酚酞溶液 | A.浮在水面上,熔成小球,四处游动,发出“嘶嘶”声,随之消失,溶液变成红色 |
②向新制得的Na2S溶液中满加新制的氯水 | B.有气体产生,溶液变成浅红色 |
③将一小块金属钠放入滴有酚酞溶液的冷水中 | C.剧烈反应,迅速产生大量无色气体 |
④将镁条投入稀盐酸中 | D.反应不十分剧烈;产生无色气体 |
⑤将铝条投入稀盐酸中 | E.生成白色胶状沉淀,继而沉淀消失 |
⑥向A1Cl3溶液中滴加NaOH溶液至过量 | F.生成淡黄色沉锭 |
请你帮助该同学整理并完成实验报告。
(1)实验目的:研究____________元素性质递变规律。
(2)实验用品:试剂:金属钠,镁条,铝条,稀盐酸,新制氯水,新制Na2S溶液,AlC13溶液,NaOH溶液,酚酞溶液等。仪器:①__________,②__________,试管,试管夹,胶头滴管,镊子,小刀,玻璃片,砂纸,火柴等。
(3)实验内容:(填写与实验步骤对应实验现象的编号和②的化学方程式及此实验的结论)__________
实验内容 | ① | ② | ③ | ④ | ⑤ | ⑥ |
实验现象(填A~F) |
①_____________________________________,
②_____________________________________,
此实验的结论:_______________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中发生反应:xA(g)+yB(g)![]() zC(g),平衡时测得A的浓度为0.50mol/L,保持温度不变,将容器的容积扩大到原来的两倍,再达平衡时,测得A的浓度0.30mol/L。下列有关判断正确的是( )
zC(g),平衡时测得A的浓度为0.50mol/L,保持温度不变,将容器的容积扩大到原来的两倍,再达平衡时,测得A的浓度0.30mol/L。下列有关判断正确的是( )
A.x+y<z
B.平衡向正反应方向移动
C.A的转化率降低
D.C的体积分数增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年是元素周期表发表150周年,期间科学家为完善周期表做出了不懈努力。中国科学院院士张青莲教授曾主持测定了铟(49In)等9种元素相对原子质量的新值,被采用为国际新标准。铟与铷(37Rb)同周期。下列说法不正确的是
A. In是第五周期第ⅢA族元素
B. 11549In的中子数与电子数的差值为17
C. 原子半径:In>Al
D. 碱性:In(OH)3>RbOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X(g)+3Y (g)![]() 2W(g) +M (g) △H=-a kJ·mol-1(a>0)。一定温度下,在体积恒定的密闭容器中,加入1 mol X(g) 与1mol Y (g),下列说法正确的是
2W(g) +M (g) △H=-a kJ·mol-1(a>0)。一定温度下,在体积恒定的密闭容器中,加入1 mol X(g) 与1mol Y (g),下列说法正确的是
A. 充分反应后,放出热量为a kJ
B. 当反应达到平衡状态时,X与W的物质的量浓度之比一定为1:2
C. 当X的物质的量分数不再改变,表明该反应已达平衡
D. 若增大Y的浓度,正反应速率增大,逆反应速率减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2013年12月2日,“嫦娥三号”探测器由长征三号乙运载火箭从西昌卫星发射中心发射,首次实现月球软着陆和月面巡视勘察。“长征”系列火箭用偏二甲肼(C2H8N2)作燃料,四氧化二氮作氧化剂,生成氮气和二氧化碳气体。
(1)写出反应的化学方程式:_____________________________________________。
(2)该反应是________(填“放热”或“吸热”)反应,反应物的总能量________(填“大于”“小于”或“等于”)生成物的总能量,断开化学键________的总能量小于形成化学键________的总能量(填“吸收”或“放出”)。
(3)如果一个反应可以分几步进行,则各分步反应的反应热之和与该反应一步完成时的反应热是相同的,这个规律称为盖斯定律。据此回答下列问题。
已知:Na2CO3·10H2O(s)===Na2CO3(s)+10H2O(g)ΔH1=+532.36kJ·mol-1
Na2CO3·10H2O(s)===Na2CO3·H2O(s)+9H2O(g) ΔH2=+473.63kJ·mol-1
写出Na2CO3·H2O脱水反应的热化学方程式____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】第ⅤA族元素的原子R与A原子结合形成RA3气态分子,其立体结构呈三角锥形。RCl5在气态和液态时,分子结构如图所示,下列关于RCl5分子的说法中不正确的是( )
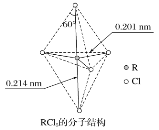
A.并不是每个原子都达到8电子稳定结构
B.键角(Cl—R—Cl)有90°、120°、180°几种
C.RCl5受热后会分解生成分子RCl3,RCl5和RCl3都是极性分子
D.分子中5个R—Cl键键能不都相同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com