
(9分)某学习小组设计了如图所示的实验方案来制取次氯酸钠和探究氯水的性质。
图中:①为氯气发生装置;②试管里盛有15 mL 8% NaOH溶液,并置于冰水浴中;
③试管里是滴有酚酞的NaOH溶液;④为尾气吸收装置。
请填写下列空白:
(1)实验前必须对整套装置进行的操作是 ;
(2)制取氯气时,在烧瓶里加入一定量的二氧化锰,通过__________(填写仪器名称)向烧瓶中加入适量的浓盐酸。实验时为了除去氯气中的氯化氢气体,可在①与②之间安装盛有 (填写下列编号字母)的净化装置。
a.碱石灰 b.饱和食盐水
c.浓硫酸 d.饱和碳酸氢钠溶液
(3)写出②装置中发生的离子反应方程式 ;
(4)实验中可观察到③试管的实验现象是溶液褪色。某同学提出两种猜想:
猜想一:氯气与NaOH溶液发生反应使溶液褪色
猜想二:
请设计实验验证哪种猜想是正确的?
(9分)(1)检查装置的气密性(1分);(2)分液漏斗(1分);b(1分);
(3)2OH-+Cl2 = Cl-+ClO-+H2O(2分);
(4)氯水中含有的HClO起漂白作用(2分);
取褪色后的溶液少量于试管中,滴加几滴NaOH溶液。若溶液恢复红色,说明猜想一是正确的,若溶液未恢复红色,说明猜想二是正确的(2分);
【解析】
试题分析:(1)该装置是制取氯气并检验氯水等,有气体参加,所以实验前必须对整套装置进行的操作是检查装置的气密性;(2)制取氯气时,在烧瓶里加入一定量的二氧化锰,通过分液漏斗向烧瓶中加入浓盐酸;这时在烧瓶中发生反应:MnO2+4HCl(浓)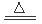 MnCl2+Cl2↑+2H2O,由于浓盐酸有挥发性,所以在制取的氯气中含有杂质HCl,实验时为了除去氯气中的氯化氢气体,可在①与②之间安装盛有饱和食盐水的装置,既可以除去杂质HCl,又可以减少Cl2的消耗;而其余的试剂,碱石灰、饱和碳酸氢钠溶液与两种物质都发生反应,不能使用,浓硫酸与两种物质都不能反应,也不能使用。故选项是b;(3)在②装置中Cl2与NaOH溶液发生反应产生次氯酸钠,发生的离子反应方程式是2OH-+Cl2 = Cl-+ClO-+H2O;(4)实验中可观察到③试管的实验现象是溶液褪色。某同学提出两种猜想:猜想一:氯气与NaOH溶液发生反应使溶液褪色;猜想二:氯水中含有的HClO起漂白作用,将红色物质氧化漂白,是物质褪色。设计实验验证哪种猜想是正确的是措施是向该无色溶液中加入过量的NaOH溶液,是溶液显碱性,若溶液变为红色,说明猜想一是正确的,若溶液未恢复红色,说明猜想二是正确的。
MnCl2+Cl2↑+2H2O,由于浓盐酸有挥发性,所以在制取的氯气中含有杂质HCl,实验时为了除去氯气中的氯化氢气体,可在①与②之间安装盛有饱和食盐水的装置,既可以除去杂质HCl,又可以减少Cl2的消耗;而其余的试剂,碱石灰、饱和碳酸氢钠溶液与两种物质都发生反应,不能使用,浓硫酸与两种物质都不能反应,也不能使用。故选项是b;(3)在②装置中Cl2与NaOH溶液发生反应产生次氯酸钠,发生的离子反应方程式是2OH-+Cl2 = Cl-+ClO-+H2O;(4)实验中可观察到③试管的实验现象是溶液褪色。某同学提出两种猜想:猜想一:氯气与NaOH溶液发生反应使溶液褪色;猜想二:氯水中含有的HClO起漂白作用,将红色物质氧化漂白,是物质褪色。设计实验验证哪种猜想是正确的是措施是向该无色溶液中加入过量的NaOH溶液,是溶液显碱性,若溶液变为红色,说明猜想一是正确的,若溶液未恢复红色,说明猜想二是正确的。
考点:考查氯气的制取、性质、试剂的选择、物质制取的离子方程式的书写、实验方案的设计与验证。
考点分析: 考点1:物质的制备 考点2:综合性实验 考点3:卤素 试题属性

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:2014-2015学年湖南省长望浏宁四县高三一模考试化学试卷(解析版) 题型:填空题
【化学-选修3物质结构与性质】(15分)早期发现的一种天然二十面体准晶颗粒由Al、Cu、Fe三种金属元素组成。回答下列问题:
(1)准晶是一种无平移周期序,但有严格准周期位置序的独特晶体,可通过________方法区别晶体、准晶体和非晶体。
(2)基态Fe原子有_______个未成对电子,Fe3+的电子排布式为_________。可用硫氰化钾检验Fe3+,形成的配合物的颜色为____________。
(3)新制的Cu(OH)2可将乙醛(CH3CHO)氧化成乙酸,而自身还原成Cu2O。乙醛中碳原子的杂化轨道为___________,1mol乙醛分子中含有的 键的数目为___________。乙酸的沸点明显高于乙醛,其主要原因是___________ 。Cu2O为半导体材料,在其立方晶胞内部有4个氧原子,其余氧原子位于面心和定点,则该晶胞中有 个铜原子。
键的数目为___________。乙酸的沸点明显高于乙醛,其主要原因是___________ 。Cu2O为半导体材料,在其立方晶胞内部有4个氧原子,其余氧原子位于面心和定点,则该晶胞中有 个铜原子。
(4)Al单质为面心立方晶体,其晶胞参数 nm,晶胞中铝原子的配位数为 。列式表示Al单质的密度 g
nm,晶胞中铝原子的配位数为 。列式表示Al单质的密度 g cm-3。
cm-3。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年黑龙江省绥化市高三下学期开学联考化学试卷(解析版) 题型:选择题
在下列反应中,水仅作还原剂的是
A.Na2O+H2O=2NaOH B.2F2+2H2O=4HF+O2
C.Cl2+H2O=HCl+HClO D.2K+2H2O=2KOH+H2↑
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省漳州市高三3月质量检查化学试卷(解析版) 题型:选择题
下列对化学知识的认识正确的是
A.H2与T2互为同位素 B.氯化铵、氯化银都属于强电解质
C.离子化合物中一定不含共价键 D.SO2、CO均属于酸性氧化物
查看答案和解析>>
科目:高中化学 来源:2014-2015四川省资阳市高一上学期学期期末化学试卷(解析版) 题型:选择题
将NaOH溶液逐滴加入到用盐酸酸化的AlCl3溶液中,若用y轴表示Al(OH)3沉淀的量,x轴表示NaOH溶液的体积,下列图象正确的是

查看答案和解析>>
科目:高中化学 来源:2014-2015四川省资阳市高一上学期学期期末化学试卷(解析版) 题型:选择题
在含有Fe3+、Fe2+、Al3+、Cl-的稀溶液中,加入足量的Na2O2固体,充分反应后再加入过量的稀盐酸,溶液中离子数目变化最小的是
A.Al3+ 、Cl- B.Al3+ C.Fe2+、Cl- D.Fe3+
查看答案和解析>>
科目:高中化学 来源:2014-2015四川省资阳市高二上学期学期期末化学试卷(解析版) 题型:填空题
(8分)恒容体系,发生如下反应2A(g) B(g)+xC(g) ΔH,起始时B、C物质的量浓度为0,A的物质的量浓度随时间变化如图。某课外活动小组一共进行了如图所示的三个实验(其中T1、T2表示不同的反应温度)。
B(g)+xC(g) ΔH,起始时B、C物质的量浓度为0,A的物质的量浓度随时间变化如图。某课外活动小组一共进行了如图所示的三个实验(其中T1、T2表示不同的反应温度)。

(1)在实验Ⅲ中,0~20min的时间内,v(A)= 。
(2)分析实验I和实验II的数据,可知x= ;分析实验II和实验Ⅲ的数据,可知反应热ΔH 0(选填“>”、“=”或者“<”)。
(3)能说明该反应达到平衡状态的是(选填代号字母) 。
a.A的质量不再变化
b.混合气体的密度保持不变
c.用A、B、C表示的反应速率的比为2∶1∶x
d.单位时间内生成n mol B的同时生成2n mol A
e.混合气体的平均摩尔质量保持不变
(4)T1℃时,保持容器的体积不变,若充入a mol A、b mol B、c mol C,达到平衡时C的体积分数为0.4,则a、b、c应满足什么条件 。
查看答案和解析>>
科目:高中化学 来源:2014-2015上海市高一上学期期末考试化学试卷(解析版) 题型:选择题
已知一个SO2分子的质量为n kg,一个SO3分子的质量为m kg(设两种分子中S、O原子分别具有相同的中子数),若以硫原子质量的1/32作标准,SO2的相对分子质量为
A. B.
B. C.
C. D.
D.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com