
【题目】早在2000多年前,人们发现柳树皮中含有一种具有解热镇痛功效的物质—水杨酸,此后科学家对水杨酸的结构进行一系列改造,合成出疗效更佳的长效缓释阿司匹林,其开发过程蕴含着重要的思想方法,请回答下列问题:

(1)水杨酸的结构与性质
①水杨酸中含氧官能团的名称是____________、______________。
②下列关于水杨酸的说法正确的是__________。
A.分子式为C7H7O3
B.1 mol水杨酸能与2 molNaOH反应
C.可发生加成、取代、消去反应
(2)水杨酸的合成
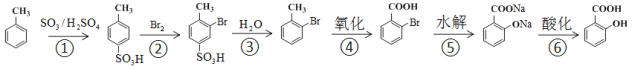
①由![]() 制
制![]() ,不采取甲苯直接与Br2直接反应,而是经过步骤①~③,目的是_______________
,不采取甲苯直接与Br2直接反应,而是经过步骤①~③,目的是_______________
②步骤④~⑥的顺序能够改为水解、酸化、氧化?____________(填“能”或“不能”),理由是__________________________________
(3)水杨酸具有解热镇痛的功效,但是其酸性很强,对人的肠胃有刺激性,容易引发胃溃疡,1897年德国化学家菲利克斯·霍夫曼对水杨酸的结构进行改造合成出阿司匹林。
①水杨酸的酸性主要来源于-COOH,将-OH转化为-OOCCH3,可使-COOH的酸性大大降低。科学家的这一设计思路依据的原理是_________________________________________
②水杨酸到阿司匹林的反应类型是_________
(4)1982年拜尔公司将阿司匹林与聚甲基丙烯酸借助乙二醇嫁接起来,研制出长效缓释阿司匹林,可减少每天吃药次数,大大方便了人们对药物的使用。
①长效缓释阿司匹林在人体内释放出阿司匹林的反应类型是______________
②写出乙烯经2步合成乙二醇的化学方程式_______________________、________________
③以烃A为原料,合成聚甲基丙烯酸的路线如下:
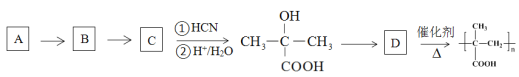
已知:
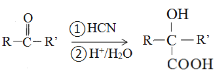
(R、R’为烃基或氢原子)
请填写有机物A~D的结构简式,在所有箭头上标注试剂和条件_______________________。
【答案】羟基 羧基 B 防止生成![]() 副产物 不能 酚羟基也容易被氧化 官能团之间的相互影响 取代反应 水解反应
副产物 不能 酚羟基也容易被氧化 官能团之间的相互影响 取代反应 水解反应 ![]()
![]()
【解析】
(1)根据水杨酸( )的结构简式结合官能团的性质分析解答;
)的结构简式结合官能团的性质分析解答;
(2)①![]() 中甲基为邻对位定位基;②酚羟基容易被氧化,据此分析解答;
中甲基为邻对位定位基;②酚羟基容易被氧化,据此分析解答;
(3)①有机物中的官能团相互间存在影响,据此解答;②水杨酸到阿司匹林是水杨酸的-OH转化为-OOCCH3,据此解答;
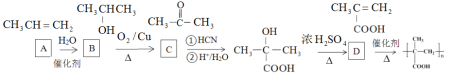
(4)①长效缓释阿司匹林在人体内可缓慢释放出阿司匹林分子,反应的化学方程式为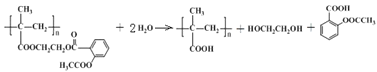 ,据此分析判断反应类型;②乙烯经2步合成乙二醇,可以首先用乙烯与溴加成生成1,2-二溴乙烷,然后将1,2-二溴乙烷水解即可,据此书写反应的化学方程式;③根据已知信息,C在
,据此分析判断反应类型;②乙烯经2步合成乙二醇,可以首先用乙烯与溴加成生成1,2-二溴乙烷,然后将1,2-二溴乙烷水解即可,据此书写反应的化学方程式;③根据已知信息,C在![]() 条件下反应生成
条件下反应生成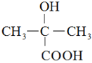 ,则C中含有C=O,判断出C为
,则C中含有C=O,判断出C为![]() ,要合成
,要合成![]() ,可以由
,可以由![]() 氧化得到,
氧化得到,![]() 可以由丙烯与水加成得到,根据最终产物的结构简式可知,是D发生加聚反应得到的,判断出D的结构,据此分析解答。
可以由丙烯与水加成得到,根据最终产物的结构简式可知,是D发生加聚反应得到的,判断出D的结构,据此分析解答。
(1)①水杨酸( )中含氧官能团有羟基、羧基,故答案为:羟基;羧基;
)中含氧官能团有羟基、羧基,故答案为:羟基;羧基;
②A. 由结构简式可知分子式为C7H6O3,故错误;B.1 mol水杨酸( )中含有1mol酚羟基和1mol羧基,能与2 molNaOH反应,故正确;C. 水杨酸(
)中含有1mol酚羟基和1mol羧基,能与2 molNaOH反应,故正确;C. 水杨酸( )中含有苯环,可发生加成反应、含有酚羟基和羧基,可以发生取代反应、但不能发生消去反应,故错误;故选B;
)中含有苯环,可发生加成反应、含有酚羟基和羧基,可以发生取代反应、但不能发生消去反应,故错误;故选B;
(2)①由![]() 制
制![]() ,如果采取甲苯直接与Br2直接反应,可能生成对位产物(
,如果采取甲苯直接与Br2直接反应,可能生成对位产物(![]() ),因此经过步骤①~③,保护对位氢原子不被取代,故答案为:防止生成
),因此经过步骤①~③,保护对位氢原子不被取代,故答案为:防止生成![]() 副产物;
副产物;
②步骤④~⑥的顺序不能改为水解、酸化、氧化,因为酚羟基容易被氧化,如果最后氧化,则不能得到 ,故答案为:不能;酚羟基也容易被氧化;
,故答案为:不能;酚羟基也容易被氧化;
(3)①有机物中的官能团之间能够相互影响,基于这样的思路,将水杨酸的-OH转化为-OOCCH3,可使-COOH的酸性大大降低,故答案为:官能团之间的相互影响;
②水杨酸到阿司匹林是水杨酸的-OH转化为-OOCCH3,属于取代反应,故答案为取代反应;
(4)①长效缓释阿司匹林(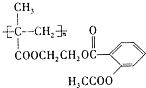 )在人体内可缓慢释放出阿司匹林分子,发生水解反应,反应的化学方程式为
)在人体内可缓慢释放出阿司匹林分子,发生水解反应,反应的化学方程式为 ,故答案为:取代反应(或水解反应);
,故答案为:取代反应(或水解反应);
②乙烯经2步合成乙二醇,可以首先用乙烯与溴加成生成1,2-二溴乙烷,然后将1,2-二溴乙烷水解即可,反应的化学方程式为![]() 、
、![]() ,故答案为:
,故答案为:![]() ;
;![]() ;
;
③根据信息可知,C在![]() 条件下反应生成
条件下反应生成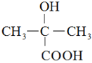 ,则C为
,则C为![]() ,要合成
,要合成![]() ,可以由
,可以由![]() 氧化得到,
氧化得到,![]() 可以由丙烯与水加成得到,根据最终的产物可知,D为
可以由丙烯与水加成得到,根据最终的产物可知,D为![]() ,因此有机物A~D的结构简式,以及试剂和条件为
,因此有机物A~D的结构简式,以及试剂和条件为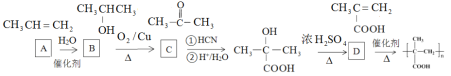 ,故答案为:
,故答案为: 。
。


 优等生题库系列答案
优等生题库系列答案科目:高中化学 来源: 题型:
【题目】室温下,用0.1 mol·Lˉ1 NaOH溶液分别滴定体积均为20mL、浓度均为0.1 mol·Lˉ1 HCl溶液和HX溶液,溶液的pH随加入NaOH溶液体积变化如图,下列说法不正确的是( )

A. HX为弱酸
B. M点c(HX)—c(X-)﹥c(OH-)—c(H+)
C. 将P点和N点的溶液混合,呈酸性
D. 向N点的溶液中通入HCl至pH=7:c(Na+) ﹥c(HX)=c(Cl-) >c(X-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国是一个严重缺水的国家,污水治理越来越引起人们重视,可以通过膜电池除去废水中的乙酸钠和对氯苯酚,其原理如图所示,下列说法不正确的是

A. 电流方向从A极沿导线经小灯泡流向B极
B. B极为电池的阳极,电极反应式为CH3COO—— 8e + 4H2O ═ 2HCO3—+9H+
C. 当外电路中有0.2 mol e转移时,通过质子交换膜的H+的个数为0.2NA
D. A极的电极反应式为![]() + H++2e ═ Cl+
+ H++2e ═ Cl+ ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以![]() 、软锰矿(主要成分为
、软锰矿(主要成分为![]() ,少量
,少量![]() 及
及![]() 的化合物等)、氨水及净化剂等为原料可制备
的化合物等)、氨水及净化剂等为原料可制备![]() 液和
液和![]() ,主要实验步骤如下
,主要实验步骤如下

步骤I、如图所示装置,将![]() 通入
通入![]() 中的软锰矿浆液中
中的软锰矿浆液中![]() 。
。
步骤II、充分反应后,在不断搅拌下依次向仪器![]() 中加入适量纯净的
中加入适量纯净的![]() ,最后加入适量
,最后加入适量![]() 沉铅,
沉铅,
步骤III、过滤得![]() 溶液
溶液
(1)仪器R的名称是_______。
(2)装置![]() 用于制取
用于制取![]() ,反应的化学方程式为_________。
,反应的化学方程式为_________。
(3)装置![]() 中的反应应控制在90~100℃,适宜的加热方式是______________。
中的反应应控制在90~100℃,适宜的加热方式是______________。
(4)装置![]() 的作用是______________________。
的作用是______________________。
(5)“步骤Ⅱ”中加入纯净![]() 的目的是_______________,用
的目的是_______________,用![]() 调节溶液
调节溶液![]() 时,需调节溶液
时,需调节溶液![]() 的范围为________(该实验条件下,部分金属离子开始沉淀和沉淀完全的
的范围为________(该实验条件下,部分金属离子开始沉淀和沉淀完全的![]() 如下表)
如下表)
金属离子 |
|
|
|
|
开始沉淀的 | 7.04 | 1.87 | 3.32 | 7.56 |
沉淀完全的 | 9.18 | 3.27 | 4.9 | 10.2 |
(6)已知①用空气氧化![]() 浊液可制备
浊液可制备![]() ,主要副产物为
,主要副产物为![]() ;反应温度和溶液
;反应温度和溶液![]() 对产品中
对产品中![]() 的质量分数的影响分别如图所示
的质量分数的影响分别如图所示

②反应温度超过![]() 时,
时,![]() 的产率开始降低,
的产率开始降低,![]() 是白色沉淀,
是白色沉淀,![]() 呈黑色;
呈黑色;![]() 、
、![]() 中锰的质量分数理论值依次为72.05%、62.5%请补充完整由步骤III得到
中锰的质量分数理论值依次为72.05%、62.5%请补充完整由步骤III得到![]() 溶液,并用氨水等制备较纯净的
溶液,并用氨水等制备较纯净的![]() 的实验方案:______________________,真空干燥6小时得产品
的实验方案:______________________,真空干燥6小时得产品![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从废旧锂离子二次电池(主要成分为![]() ,还含有少量石墨和金属钢売、铝箔等杂质)中回收钴和锂的工艺流程如下:回答下列问题:
,还含有少量石墨和金属钢売、铝箔等杂质)中回收钴和锂的工艺流程如下:回答下列问题:

(1)![]() 的电子式为__________。“碱浸”的目的是____________。
的电子式为__________。“碱浸”的目的是____________。
(2)“酸浸”过程中![]() 发生反应的离子方程式为______________,浸渣中含有的主要成分是_______________________。
发生反应的离子方程式为______________,浸渣中含有的主要成分是_______________________。
(3)“萃取净化”除去的杂质离子除![]() 外,还有________(填离子符号)
外,还有________(填离子符号)
(4)“苯取分离“中钴、锂的萃取率与平衡时溶液![]() 的关系如图所示,
的关系如图所示,![]() 一般选择5左右,理由是_____________________________________。
一般选择5左右,理由是_____________________________________。

(5)“沉锂“中![]() 的溶解度随温度变化的曲线如图所示:
的溶解度随温度变化的曲线如图所示:
①根据平衡原理分析![]() 在水中的溶解度随温度变化的原因______________。
在水中的溶解度随温度变化的原因______________。
②为获得高纯![]() ,提纯操作依次为热过滤、_______、烘干。
,提纯操作依次为热过滤、_______、烘干。
③若“沉锂”中![]() ,加入等体积等浓度
,加入等体积等浓度![]() 溶液,则此时沉锂率为________________。(已知
溶液,则此时沉锂率为________________。(已知![]() 的
的![]() 为
为![]() )
)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的值。下列有关叙述正确的是
A. 100g 46%的乙醇溶液中,含H-O键的数目为7NA
B. pH=1的H3PO4溶液中,含有0.1NA个H+
C. 0.1mol Fe在足量氧气中燃烧,转移电子数为0.3NA
D. 1L 0.1mol·L-1的NH4Cl溶液中含有NH4+数目为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有下列6种物质
①![]() ②
②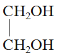 ③
③![]()
④CH3-CH=CH-CH3 ⑤![]() ⑥
⑥![]()
(1)用于制造炸药TNT的是____(填序号)。
(2)具有两性的是______(填序号)。
(3)有机物①的沸点比②______(填“高”或“低”)
(4)有机物④的名称是___________
(5)有机物④形成的高聚物结构简式为__________________
(6)检验有机物⑥中官能团的试剂是_________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室需要0.1mol/LNaOH溶液450mL和0.5mol/L的硫酸溶液500mL。根据这两种溶液的配制情况回答下列问题。
(1)在下图所示仪器中,配制上述溶液肯定不需要的是_________(填序号),除图中已有仪器外,配制上述溶液还需要的玻璃仪器是__________。

(2)在容量瓶的使用方法中,下列操作不正确的是____________
A.使用容量瓶前检验是否漏水 |
B.容量瓶用水洗净后,再用待配溶液洗涤 |
C.配制溶液时,如果试样是固体,把称好的固体用纸条小心倒入容量瓶中,缓慢加水至接近刻度线1~2cm处,用胶头滴管加蒸馏水至刻度线。 |
D.配制溶液时,若试样是液体,用量筒取样后用玻璃棒引流倒入容量瓶中,缓慢加水至刻度线1~2cm处,用胶头滴管加蒸馏水至刻度线。 |
E.盖好瓶塞,用食指顶住瓶塞,另一只手托住瓶底,把容量瓶反复倒转多次,摇匀。
(3)根据计算用托盘天平称取的质量为______g。在实验中其他操作均正确,若定容时仰视刻度线,则所得溶液浓度_____0.1mol/L(填“大于”“小于”或“等于”)。
(4)根据计算得知,需用量筒量取质量分数为98%、密度为1.84g/cm3的浓硫酸的体积为_______mL,如果实验室有15mL、20mL、50mL量筒,应选用______mL量筒最好。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ实验室里需要纯净的氯化钠溶液,但实验室只有混有硫酸钠、碳酸氢铵的氯化钠.某学生设计了如下方案进行提纯:

(1)操作②能否改为加硝酸钡溶液,______(填“能”或“否”) ,理由_____________________________。
(2)进行操作②后,如何判断SO42- 已除尽,方法是___________________。
(3)操作④的目的是_______________________________。
Ⅱ硫酸亚铁铵(NH4)2SO4·FeSO4·6H2O为浅绿色晶体,实验室中常以废铁屑为原料来制备,其步骤如下:
步骤1 将废铁屑放入碳酸钠溶液中煮沸除油污,分离出液体,用水洗净铁屑。
步骤2 向处理过的铁屑中加入过量的3mol/L H2SO4溶液,在60℃左右使其反应到不再产生气体,趁热过滤,得FeSO4溶液。
步骤3 向所得FeSO4溶液中加入饱和(NH4)2SO4溶液,经过“一系列操作”后得到硫酸亚铁铵晶体。
请回答下列问题:
(1)在步骤1中,分离操作,所用到的玻璃仪器有___________________________。(填仪器编号)
①漏斗 ②分液漏斗 ③烧杯 ④广口瓶 ⑤铁架台 ⑥玻璃棒 ⑦酒精灯
(2)在步骤3中,“一系列操作”依次为_____________________、_______________________和过滤。
(3)实验室欲用18mol/L H2SO4来配制240mL 3mol/L H2SO4溶液,需要量取________mL浓硫酸,实验时,下列操作会造成所配溶液浓度偏低的是__________________。(填字母)
a.容量瓶内壁附有水珠而未干燥处理 b.未冷却至室温直接转移至容量瓶中
c.加水时超过刻度线后又倒出 d.定容时仰视刻度线
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com