铝能用于冶炼金属(如Fe、V、Mn等),这是因为铝______.
A.具有两性
B.导电性好
C.还原性强
D.在冶炼反应中放出大量热
为确定某铝热剂(含氧化铁和铝)的组成,分别进行下列实验:
(1)若取a g样品,向其中加入足量的NaOH溶液,测得生成的气体(标准状况,下同)体积为b L.反应的化学方程式是______,样品中铝的质量是______g.
(2)若取a g样品将其点燃,恰好完全反应,该反应的化学方程式是______,氧化铁与铝的质量比是______.
(3)待(2)中反应产物冷却后,加入足量的盐酸,测得生成的气体体积为c L,该气体与(1)中所得气体的体积比c:b=______.
解:铝虽然导电性好,也能与强酸、强碱溶液反应,但与金属的冶炼无关,金属冶炼的本质是金属离子得电子被还原为单质,所以在冶炼金属方面,主要还是利用了铝的还原性,在铝热反应中放出大量热,以利于反应持续进行,故选CD;
(1)氧化铁和氢氧化钠溶液不反应,铝和氢氧化钠溶液反应生成偏铝酸钠和氢气,反应方程式为:2Al+2NaOH+2H
2O=2NaAlO
2+3H
2↑,根据方程式知,铝的质量=
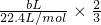
×27g/mol=

,
故答案为:2Al+2NaOH+2H
2O=2NaAlO
2+3H
2↑,
(2)铝与氧化铁在高温下生成铁与氧化铝,反应方程式为2Al+Fe
2O
3
2Fe+Al
2O
3;由二者恰好反应,根据方程式可知,
质量之比等于总的相对分子质量之比,则样品中氧化铁与铝的质量比为(56×2+16×3):2×27=80:27,
故答案为:2Al+Fe
2O
3
2Fe+Al
2O
3,80:27;
(3)由方程式2Al+Fe
2O
3
2Fe+Al
2O
3可知,(2)中生成的n(Fe)等于铝热剂中n(Al),与盐酸反应生成的氢气体积之比等于金属提供的电子的物质的量之比,所以(3)中生成的氢气与(1)中生成氢气体积之比c:b=2n(Fe):3n(Al)=2:3,
故答案为:2:3.
分析:金属冶炼的本质是金属离子得电子被还原为单质,反应在高温下进行;
(1)氧化铁和氢氧化钠溶液不反应,铝和氢氧化钠溶液反应生成偏铝酸钠和氢气,根据氢气的体积计算铝的质量;
(2)铝与氧化铁在高温下生成铁与氧化铝;由二者恰好反应,根据方程式可知,质量之比等于总的相对分子质量之比;
(3)由方程式可知,(2)中生成的n(Fe)等于铝热剂中n(Al),与盐酸反应生成的氢气体积之比等于金属提供的电子的物质的量之比.注意铁与盐酸反应生成氯化亚铁.
点评:本题考查常用化学用语、根据方程式的计算等,难度不大,会根据方程式进行有关计算.

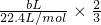 ×27g/mol=
×27g/mol= ,
, 2Fe+Al2O3;由二者恰好反应,根据方程式可知,
2Fe+Al2O3;由二者恰好反应,根据方程式可知, 2Fe+Al2O3,80:27;
2Fe+Al2O3,80:27; 2Fe+Al2O3可知,(2)中生成的n(Fe)等于铝热剂中n(Al),与盐酸反应生成的氢气体积之比等于金属提供的电子的物质的量之比,所以(3)中生成的氢气与(1)中生成氢气体积之比c:b=2n(Fe):3n(Al)=2:3,
2Fe+Al2O3可知,(2)中生成的n(Fe)等于铝热剂中n(Al),与盐酸反应生成的氢气体积之比等于金属提供的电子的物质的量之比,所以(3)中生成的氢气与(1)中生成氢气体积之比c:b=2n(Fe):3n(Al)=2:3,

 名校课堂系列答案
名校课堂系列答案