
 大理石与盐酸反应的反应速率如图所示,已知反应为放热反应.
大理石与盐酸反应的反应速率如图所示,已知反应为放热反应.

 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
A、过量的SO2通入氨水中:NH3?H20+SO2
| ||||
B、实验室制备氯气:MnO2+4H++2Cl-
| ||||
C、磁性氧化铁溶于稀硝酸:3Fe2++4H++NO3-
| ||||
D、明矾溶液中滴入Ba(OH)2溶液使SO42-恰好完全沉淀:2Ba2++3OH-+Al3++2SO42-
|
查看答案和解析>>
科目:高中化学 来源: 题型:
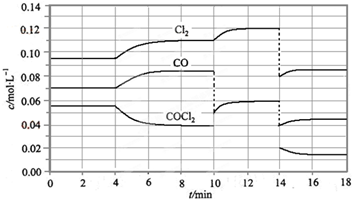
查看答案和解析>>
科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
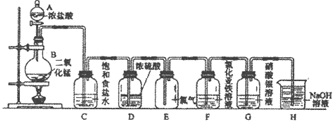
查看答案和解析>>
科目:高中化学 来源: 题型:
| a |
| b |
| 1 |
| 2 |
| a |
| b |
| a |
| b |
| 3 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 配料表 | 精制海盐、碘酸钾 |
| 含碘量 | 20~40mg/kg |
| 卫生许可证号 | ××卫碘字(1999)第001号 |
| 分装日期 | 见封底 |
| 储藏方法 | 密封、避光、防潮 |
| 食用方法 | 烹调时,待食品熟后加入碘盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、SO2具有漂白性,故可使酸性KMnO4溶液褪色 |
| B、浓硝酸中的HNO3见光会分解,故有时在实验室看到的浓硝酸呈黄色 |
| C、Na的金属性比Mg强,故可用Na与MgCl2溶液反应制取Mg |
| D、Fe在Cl2中燃烧生成FeCl3,故在与其他非金属反应的产物中Fe也显+3价 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com