
����Ŀ��ClO2��Ϊһ�ֹ����͵�����������������ȡ��Cl2��Ϊ����ˮ������������֪ClO2��һ��������ˮ���������л��ܼ������壬11��ʱҺ���ɺ���ɫҺ�塣
��1��ij�о�С������ͼװ���Ʊ�����ClO2���г�װ������ȥ����
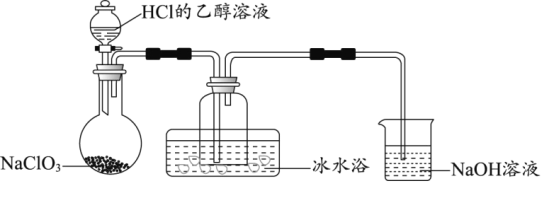
�ٱ�ˮԡ��������___��
��NaOH��Һ����Ҫ����Ϊ���շ�Ӧ������Cl2��������Һ��������ȡƯ��Һ�������շ�Ӧ�����ӷ���ʽΪ___���÷�Ӧ���������뻹ԭ�����ʵ���֮��Ϊ___��
����NaClO3��HClΪԭ���Ʊ�ClO2����ɻ�ѧ����ʽ___��
��2����ClO2ˮ��Һ�μӵ�KI��Һ�У���Һ���ػƣ��������м�������������Һ�������ã��۲쵽___��֤��ClO2���������ԡ�
��3��ClO2��ɱ�����������л����Cl-����0.0001mol��L-1��AgNO3����Һ�ζ����յ㣬���ⶨ����ˮ����Cl-�ĺ�����
���ڵζ�����װ��AgNO3����Һ��ǰһ����Ӧ���еIJ���___��
�����ڵζ��յ��ȡ�ζ��̶ܿ�ʱ�����ӱ�ҺҺ�棬��ⶨ���___������ƫ��������ƫ����������Ӱ��������
���𰸡��ռ�ClO2����ʹClO2����ΪҺ�壩 Cl2+OH-=Cl-+ClO-+H2O 1��1 2NaClO3+4HCl=2ClO2��+ Cl2��+2NaCl+2H2O ��Һ��Ϊ��ɫ ��AgNO3����Һ������ϴ ƫ��
��������
(1)�ٱ�ˮԡ�ɽ����¶ȣ���ֹ�ӷ���
���������������Ʒ�Ӧ�����Ȼ��ơ��������ƣ�
����NaClO3��HClΪԭ���Ʊ�ClO2��ͬʱ��Cl2��NaCl���ɣ���ϵ����غ��ԭ���غ�д��������Ӧ�Ļ�ѧ����ʽ��
(2)��Ӧ���ɵ⣬�����������Ȼ�̼���²�Ϊ��ɫ��
(3)���ݵζ���������
(1)�ٱ�ˮԡ�ɽ����¶ȣ���ֹ�ӷ����������������ռ�ClO2���ʴ�Ϊ���ռ�ClO2(��ʹClO2����ΪҺ��)��
���������������Ʒ�Ӧ�����Ȼ��ơ��������ƣ���Ӧ�Ļ�ѧ����ʽΪCl2+2NaOH=NaCl+NaClO+H2O�������ӷ���ʽΪ��Cl2+OH-=Cl-+ClO-+H2O���˷�Ӧ��Cl2���������������ǻ�ԭ������ԭ����NaCl����������NaClO�����ʵ���֮��Ϊ1:1��������շ�Ӧ���������뻹ԭ��֮��Ϊ1:1���ʴ�Ϊ��Cl2+OH-=Cl-+ClO-+H2O��1��1��
����NaClO3��HClΪԭ���Ʊ�ClO2��ͬʱ��Cl2��NaCl���ɣ�������Ӧ�Ļ�ѧ����ʽΪ2NaClO3 + 4HCl= 2ClO2��+ Cl2��+2NaCl+2H2O���ʴ�Ϊ��2NaClO3+4HCl=2ClO2��+ Cl2��+2NaCl+2H2O��
(2)��ClO2ˮ��Һ�μӵ�KI��Һ�У���Һ���ػƣ�˵�����ɵ⣬�����������Ȼ�̼�������۲쵽��Һ�ֲ㣬�²�Ϊ�Ϻ�ɫʱ��˵����I2���ɣ�����ClO2���������ԣ��ʴ�Ϊ����Һ��Ϊ��ɫ��
(3)��װ��AgNO3����Һ��Ӧ����Ũ�Ƚ��ͣ�Ӧ��AgNO3����Һ������ϴ����װ��AgNO3����Һ���ʴ�Ϊ����AgNO3����Һ������ϴ��
���ڵζ��յ��ȡ�ζ��̶ܿ�ʱ�����ӱ�ҺҺ�棬�������ı�Һ���������ƫС����ⶨ���ƫ�ͣ��ʴ�Ϊ��ƫ�͡�


 ��ǰ����ϵ�д�
��ǰ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ҹ���ѧ����ƶ�����̼���β��绯ѧת��װ�ã���ʾ��ͼ���£�
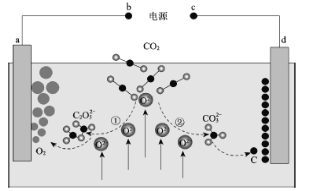
����˵����ȷ����
A.bΪ��Դ�ĸ�����dΪ���ص�����
B.���̢٢��в���CO2ʱ̼�Ļ��ϼ۷����˱仯
C.a���ĵ缫��ӦʽΪ2C2O52����4e����4CO2����O2��
D.����װ�����ܷ�Ӧ�Ļ�ѧ����ʽΪC��O2��CO2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��4NH3(g) + 5O2(g) =4NO(g) + 6H2O(g)����H= ��1025kJ/mol���÷�Ӧ��һ�����淴Ӧ������Ӧ����ʼ�����ʵ�����ͬ�����й��ڸ÷�Ӧ��ʾ��ͼ����ȷ����
A. 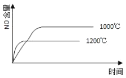
B. 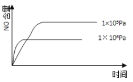
C. 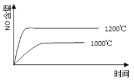
D. 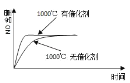
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������(SrSO4)��ˮ�еij����ܽ�ƽ��������ͼ������˵����ȷ���ǣ� ��
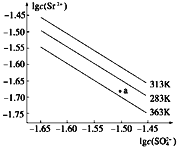
A. 283 Kʱ��ͼ��a���Ӧ����Һ�Dz�������Һ
B. ������ͬ�¶��£�363 KʱKsp(SrSO4)���
C. �¶�һ��ʱ��Ksp(SrSO4)��c(SO42-)���������С
D. 283 K�µ�SrSO4������Һ���µ�363 K���Ϊ��������Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ�����ð�����ԭ����ͭ�ķ����ⶨͭ�Ľ������ԭ����������Ӧ�Ļ�ѧ����ʽΪ��2NH3+3CuO![]() N2+3Cu+3H2O���Իش�
N2+3Cu+3H2O���Իش�
(1)���ѡ�òⶨ��Ӧ��CuO��������H2O������[m(CuO)��m(H2O)] ʱ��������ͼ�����������һ����ʵ�鷽����
(2)����д������ͼװ���Ʊ������Ļ�ѧ��Ӧ����ʽ___________________��

���������ӵ�˳��Ϊ(����ĸ��ű�ʾ���������ظ�ʹ��) ______________________��(d)��Ũ�����������___________��ʵ�����ʱ�۲쵽(a)�е�������______________________��
���г�����Cu�����ԭ�������ı���ʽ��______________________��
(2)��ͬѧ��ΪNH3��CuO��Ӧ���ɵĺ�ɫ�����п��ܺ���Cu2O����֪Cu2O�Ǻ�ɫ��ĩ����������Һ�У�Cu+����������������ԭ��Ӧ����Cu2+��Cu��
����CuOδ��ȫ�ֽ⣬�����ⶨ��Cu�����ԭ��������______________(ƫ���ƫС)��
�������һ����ʵ�����ú�ɫ�������Ƿ���Cu2O________________��
(3)�ڽ��������(2)������ͬѧ�����Cu2O��CuO�����ȶ����ĸ���ǿ���������ǽ���������ʵ�飺ȡ0.98 g Cu(OH)2���壬���ȵ�80�桫100��ʱ���õ���ɫ�����ĩ���������ȵ�1000�����ϣ���ɫ��ĩȫ����ɺ�ɫ��ĩB������ͼ��ʾ��
�ݴ˿��Ƶ�AΪ__________����AB�η����ķ�ӦΪ_________________��
�ɴ˵õ������ȶ��ԵĽ�����____________________��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ôֹ���ԭ�ϣ������ε�ⷨ��ȡ����ԭ����ͼ������������ȷ����
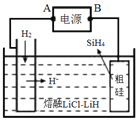
A. ��Դ��B��Ϊ����
B. ��ѡ��ʯӢ����ֹ�
C. ���ʱ����������Li+��ֹ��ƶ�
D. ������Ӧ��Si��4H����4e��= SiH4��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼΪԪ�����ڱ������ڵ�һ���֣������й�A��B��C��D����Ԫ�ص������в���ȷ���ǣ� ��

A.A��C��Ԫ���γɵĻ����ﶼΪ���ۻ�����
B.AD2�ĵ���ʽΪ![]()
C.B��C�γɵĻ�����BC��������ѧ��Ϊ�Ǽ��Թ��ۼ�
D.B2�ĽṹʽΪN��N
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������(NaN3)������������ȫ�����е�ҩ����ʵ������ȡ�������Ƶ�ԭ����ʵ��װ�ü�ʵ�鲽�����£�
�ٴ�װ��D�����ϵ�������������ȡ������
���ټ���װ��A�еĽ����ƣ�ʹ���ۻ�����ַ�Ӧ����ֹͣ����װ��D���ر�������
����װ��A��b�����ڳ�����Ƚ��ʲ����ȵ�210��220�棬Ȼ��ͨ��N2O��
����ȴ��������м����Ҵ�(����NaN3���ܽ��)����ѹŨ���ᾧ���ٹ��ˣ���������ϴ�ӣ����ɡ�

��֪��I��NaN3��������ˮ�İ�ɫ���壬�����Ҵ������������ѣ�
II��NaNH2�۵�210�棬�е�400�棬��ˮ��Һ����ˮ�⡣
��ش��������⣺
(1)װ��B��ʢ�ŵ�ҩƷΪ_____________��װ��C����Ҫ������______________________��
(2)��������ȼ���ͨ������Ŀ����_____________________________________������ڰ������ۻ����Ʒ�Ӧ����NaNH2�Ļ�ѧ����ʽΪ_______________________________��������������˵ļ��ȷ�ʽΪ ___________(����ˮԡ������������ԡ������)��
(3)N2O����NH4NO3��240��245��ֽ��Ƶ�(����淋��۵�Ϊ169.6��)�����ѡ������巢��װ����(�����)___________��

(4)����NaN3�Ļ�ѧ����ʽΪ _____________________________________��
(5)ͼ������a�õ������ʶ����ò���������Ҫԭ����__________________��
(6)�������������ϴ�ӵ���ҪĿ����_______________________________��
(7)ʵ�����õζ����ⶨ����������Ʒ��NaN3�������������ٽ�2.500 g�������500.00 mL��Һ����ȡ50.00 mL��Һ������ƿ�У�����50.00 mL 0.1010 mol��L-1(NH4)2Ce(NO3)6��Һ���۳�ַ�Ӧ����Һ��ϡ�ͣ�����Һ�м���8 mLŨ���ᣬ����3���ڷƆ���ָʾҺ����0.0500mol��L-1(NH4)2Fe(SO4)2����Һ�ζ�������Ce4+��������Һ���Ϊ29.00mL���ⶨ���̵ķ�Ӧ����ʽΪ��2(NH4)2Ce(NO3)6+2NaN3=4NH4NO3+2Ce(NO3)3+2NaNO3+3N2����Ce4++Fe2+=Ce3++Fe3+��������NaN3����������Ϊ_______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����û�ѧ��Ӧԭ���о�̼��������ĵ��ʼ��仯����ķ�Ӧ�Ի������Ⱦ����ԴΣ��������Ҫ���塣
��1��CO��ԭNO�ķ�ӦΪ2CO(g)+2NO(g)![]() 2CO2(g)+N2(g)H=-746kJ��mol-1��
2CO2(g)+N2(g)H=-746kJ��mol-1��
д���������������NOƽ��ת���ʵĴ�ʩ______________��______________��
��2���ý�̿��ԭNO�ķ�ӦΪ��2NO(g)+C(s)![]() N2(g)+CO2(g)
N2(g)+CO2(g)
H�����ݺ��������£��������ͬ�ļס��ҡ������������зֱ���������Ľ�̿��һ������NO����ø�������NO�����ʵ���[n(NO)]�淴Ӧʱ�䣨t���ı仯��������ʾ��
t/min n(NO)/mol ���� | 0 | 40 | 80 | 120 | 160 |
��/400�� | 2.00 | 1.5 | 1.10 | 0.80 | 0.80 |
��/400�� | 1.00 | 0.80 | 0.65 | 0.53 | 0.45 |
��/T�� | 2.00 | 1.45 | 1.00 | 1.00 | 1.00 |
��H______________0����������������������
����������160minʱ��v��_________v������������������������=������
��3��ij�¶��£������Ϊ2L�ĺ������������ͨ��2.0molNO2��������Ӧ��2NO2(g)![]() N2O4(g)H=-57.0kJ��mol-1����֪��v��(NO2)=k1��c2(NO2)��v��(N2O4)=k2��c(N2O4)������k1��k2Ϊ���ʳ��������NO2���������[x(NO2)]�뷴Ӧʱ�䣨t���Ĺ�ϵ�����
N2O4(g)H=-57.0kJ��mol-1����֪��v��(NO2)=k1��c2(NO2)��v��(N2O4)=k2��c(N2O4)������k1��k2Ϊ���ʳ��������NO2���������[x(NO2)]�뷴Ӧʱ�䣨t���Ĺ�ϵ�����
t/min | 0 | 20 | 40 | 60 | 80 |
x(NO2) | 1.0 | 0.75 | 0.52 | 0.50 | 0.50 |
��![]() ����ֵΪ______________��
����ֵΪ______________��
����֪���ʳ���k���¶����߶������������¶Ⱥ�k1����ı���___________k2����ı�������������������������=������
��4���ü�ӵ绯ѧ����ȥNO�Ĺ��̣���ͼ��ʾ��
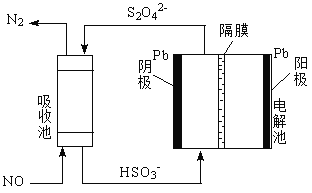
����֪���ص�����������Һ��pH��4~7֮�䣬д�������ĵ缫��Ӧʽ��______________��
�������ӷ���ʽ��ʾ���ճ��г�ȥNO��ԭ����______________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com