
【题目】海洋资源的利用具有广阔前景。
(1)无需经过化学变化就能从海水中获得的物质是__(填序号)。
A.Cl2 B.淡水 C.烧碱 D.食盐
(2)海水淡化的方法主要有___法、电渗析法、___法。
(3)如图是从海水中提取镁的简单流程。
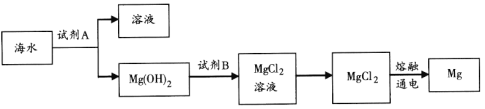
工业上常用于沉淀Mg2+的试剂A的俗名是__,无水MgCl2在熔融状态下通电制备金属Mg的化学方程式是___。
(4)海带灰中富含以I-形式存在的碘元素。实验室提取I2的途径如图所示:
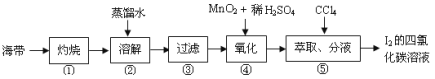
①灼烧海带至灰烬时所用的主要仪器名称是___。
②向酸化的滤液中加过氧化氢溶液,写出该反应的离子方程式__。反应结束后,再加入CCl4作萃取剂,振荡、静置,可以观察到CCl4层呈__色。
【答案】BD 蒸馏 离子交换 石灰乳 MgCl2(熔融)![]() Mg+Cl2↑ 坩埚 2I-+H2O2+2H+=I2+2H2O 紫
Mg+Cl2↑ 坩埚 2I-+H2O2+2H+=I2+2H2O 紫
【解析】
(1)从海水制备物质的原理可知,金属单质与非金属单质需要利用化学反应来制取,而食盐可利用蒸发原理,淡水利用蒸馏原理来得到,据此分析判断;
(2)根据海水淡化的常见方法分析解答;
(3)工业上常用石灰乳和镁离子反应生成Mg(OH)2;氢氧化镁和盐酸反应得到氯化镁和水;然后电解熔融状态下的氯化镁冶炼镁,据此分析解答;
(4)海带灼烧后用水溶解除去不溶物,在滤液中加入稀硫酸和过氧化氢溶液将碘离子氧化后用四氯化碳萃取出碘单质,据此分析解答。
(1)A.电解饱和氯化钠溶液得到烧碱、氢气、氯气,有新物质生成,属于化学变化,故A错误;
B.把海水用蒸馏等方法可以得到淡水,故B正确;
C.电解饱和氯化钠溶液得到烧碱、氢气、氯气,有新物质生成,属于化学变化,故C错误;
D.把海水用太阳暴晒,蒸发水分后即得食盐,不需要化学变化就能够从海水中获得,故D正确;
故选BD;
(2)蒸馏法是把水从水的混合物中分离出来,得到纯净的水,通过离子交换树脂可以除去海水中的离子,从而达到淡化海水的目的,利用电渗析法可使相应的离子通过半透膜以达到硬水软化的效果,海水含大量氯化钠等盐,冰冻法不能淡化,故答案为:蒸馏;离子交换;
(3)①工业上常用石灰乳沉淀Mg2+,CaO和H2O反应生成Ca(OH)2,Ca(OH)2和镁离子反应生成Mg(OH)2;熔融状态下,电解氯化镁冶炼镁,反应的化学方程式为MgCl2(熔融) ![]() Cl2↑+Mg,故答案为:石灰乳;MgCl2(熔融)
Cl2↑+Mg,故答案为:石灰乳;MgCl2(熔融) ![]() Cl2↑+Mg;
Cl2↑+Mg;
(4)①灼烧固体需要在坩埚中进行,故答案为:坩埚;
②向酸化的滤液中加过氧化氢溶液,过氧化氢具有氧化性,能够将碘离子氧化为单质碘,反应的离子方程式为2H++2I-+H2O2═I2+2H2O,反应结束后,再加入CCl4作萃取剂,振荡、静置,发生萃取,萃取后碘的CCl4溶液呈紫色,故答案为:2H++2I-+H2O2═I2+2H2O;紫。


科目:高中化学 来源: 题型:
【题目】现有常温下甲、乙、丙三种溶液,甲为0.1 mol·L-1的NaOH溶液,乙为0.1 mol·L-1的HCl溶液,丙为0.1 mol·L-1的CH3COOH溶液,试回答下列问题:
(1)甲溶液的pH=________。
(2)丙溶液中存在的电离平衡为______________(用电离平衡方程式表示)。
(3)常温下,用水稀释0.1 mol·L-1的CH3COOH溶液时,下列各量随水量的增加而增大的是________(填序号)。
①n(H+) ②c(H+) ③ c(CH3COOH)/c(CH3COO-) ④c(OH-)
(4)甲、乙、丙三种溶液中由水电离出的c(OH-)的大小关系为___________。
(5)某同学用甲溶液分别滴定20.00 mL乙溶液和20.00 mL丙溶液,得到如图所示的两条滴定曲线,请回答有关问题:
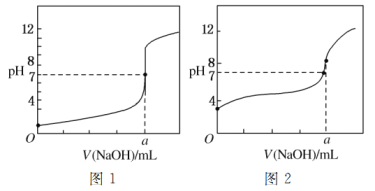
①甲溶液滴定丙溶液的曲线是________(填“图1”或“图2”)曲线。
②a=________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E五种元素,它们的核电荷数依次增大,且都小于20。其中C、E是金属元素;A和E属同族,它们原子的最外层电子排布式为ns1。B和D也属同族,它们原子最外层的p能级电子数是s能级电子数的两倍。C原子的最外层电子数等于D原子的最外层电子数的一半。请回答下列问题:
(1)写出C元素基态原子的电子排布式: ________________ 。
(2)用电子排布图表示D元素原子的价电子:__________。
(3)元素B与D的电负性的大小关系是B___ D (填“>”“<”或“=”,下同), E与C的第一电离能大小关系是E____C。
(4)写出元素E和C的最高价氧化物对应的水化物之间反应的离子方程式__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家在-100 ℃的低温下合成了一种烃X,此分子的结构如图所示(图中的连线表示化学键)。下列说法不正确的是

A. X不能使酸性KMnO4溶液褪色
B. X的性质与烯烃类似,容易发生加成反应
C. X在常温下不能稳定存在
D. 充分燃烧等质量的X和甲烷,X消耗氧气比甲烷少
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物X的结构简式如图所示。则下列有关说法中不正确的是
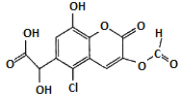
A. 能发生加成、取代、氧化反应B. 能与FeC13溶液发生显色反应
C. 1mol该物质最多可与6molH2反应D. 1mol该物质最多可与7molNaOH反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上可采用湿法技术从废印刷电路板中回收纯铜,其流程简图如下:
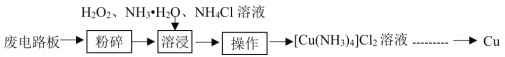
回答下列问题:
(1)开始时,将废电路板“粉碎”的目的是__________。“操作”的名称是_________________。
(2)某化学兴趣小组同学为探究“溶浸”过程中反应的实质,采用如图所示的装置,设计了如下对照实验。
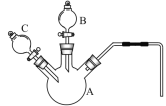
序号 | 实验名称 | 实验步骤 | 实验现象 | |
Ⅰ | 将铜片置于H2O2溶液中 | 先向A中加入0.5g光亮的铜片,再通过B加入30%的H2O2溶液 | —————— | 开始无明显现象,10小时后,溶液变为浅蓝色,铜表面附着一层蓝色固体 |
Ⅱ | 将铜片置于硫酸酸化的H2O2溶液中 | 再通过C加入8mL 5mol/L 的稀硫酸 | 开始铜片表面产生少量气泡,随着反应的进行,气泡越来越多,溶液颜色为蓝色,铜片表面保持光亮 | |
Ⅲ | 将铜片置于有氨水的H2O2溶液中 | 再快速通过C加入8mL 5mol/L的氨水 | 立即产生大量的气泡,溶液颜色变为深蓝色,铜片表面有一层蓝色固体附着,产生的气体能使带火星的木条复燃 | |
Ⅳ | 将铜片置于加有氨水和NH4Cl的H2O2溶液中 | 先向A中加入0.5g光亮的铜片和0.2g NH4Cl固体,再通过B加入30%的H2O2溶液 | 再快速通过C加入8mL 5mol/L的氨水 | 立即产生大量的气泡,______,铜片表面依然保持光亮 |
①仪器A的名称为______________________。
②实验Ⅰ中反应的化学方程式为___________________________。
③实验Ⅱ中产生的气体是________(写化学式),实验Ⅱ比实验Ⅰ/span>现象明显的原因是__________。
④实验Ⅲ中“溶液颜色变为深蓝色”所发生反应的离子方程式为________________。
⑤实验Ⅳ中空格处实验现象为__________,加入NH4Cl的作用是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种以辉铜矿(主要成分为Cu2S,含少量SiO2)为原料制备硝酸铜的工艺流程如图所示:
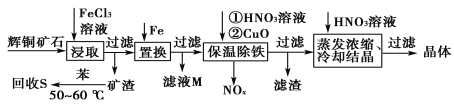
(1)写出“浸取”过程中Cu2S溶解时发生反应的离子方程式:___。
(2)恒温“浸取”的过程中发现铜元素的浸取速率先增大后减少,有研究指出CuCl2是该反应的催化剂,该过程的反应原理可用化学方程式表示为:①Cu2S +2CuCl2=4CuCl+S;②___。
(3)“回收S”过程中温度控制在50~60℃之间,不宜过高的原因是___。
(4)向滤液M中加入(或通入)___(填字母),可得到一种可循环利用的物质。
a.铁 b.氯气 c.高锰酸钾 d.氯化氢
(5)“保温除铁”过程中,加入CuO的目的是__;“蒸发浓缩、冷却结晶”过程中,要用HNO3溶液调节溶液的pH,其理由_。
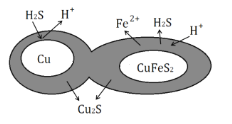
(6)辉铜矿可由黄铜矿(主要成分为CuFeS2)通过电化学反应转变而成,有关转化见图,转化时转移0.2mol电子,生成Cu2S___mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】符合分子式“C6H6”的多种可能结构如图所示,下列说法正确的是

A. 1~5对应的结构中能使溴的四氯化碳溶液褪色的有4个
B. 1~5对应的结构中一氯取代物只有1种的有3个
C. 1~5对应的结构中所有原子均可能处于同一平面的有1个
D. 1~5对应的结构均能与氢气在一定条件下发生加成反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com