
【题目】工业上用铝土矿(主要成分为Al2O3,还有少量的Fe2O3,SiO2等杂质)提取氧化铝作冶炼铝的原料,提取的操作过程如下:

(1)Ⅰ和Ⅱ步骤中分离溶液和沉淀的操作是:_____________。
(2)沉淀M中除含有泥沙外,一定还含有_________(填化学式),生成固体N反应的化学方程式为_________。
(3)滤液X中,含铝元素的溶质的化学式为___________,它属于__________(填“酸”、“碱”或“盐”)类物质。
(4)实验室里常往AlCl3溶液中加入___________(填“氨水”或“NaOH溶液”)来制取Al(OH)3,该反应的离子方程式为__________________________。
(5)滤液Y中除了含有Na2CO3或NaHCO3外,一定还含有__________________。
【答案】过滤 Fe2O3 2Al(OH)3![]() Al2O3+3H2O NaAlO2 盐 氨水 Al3++3NH3·H2O=Al(OH)3↓+3NH4+ 硅酸钠(或Na2SiO3)
Al2O3+3H2O NaAlO2 盐 氨水 Al3++3NH3·H2O=Al(OH)3↓+3NH4+ 硅酸钠(或Na2SiO3)
【解析】
铝土矿主要成分为Al2O3,还有少量的Fe2O3,SiO2等杂质,加入NaOH,Al2O3和SiO2会与之反应,得到NaAlO2、NaSiO3,向其中通入CO2气体,控制条件,得到Al(OH)3,灼烧得到Al2O3。
Al2O3
(1)Ⅰ和Ⅱ步骤中分离溶液和难溶性的固体沉淀的操作是过滤;
(2)在铝土矿中含有Al2O3、Fe2O3,SiO2等杂质,当向其中加入NaOH溶液时,两性氧化物Al2O3、酸性氧化物SiO2与NaOH发生反应,变为可溶性的物质,而碱性氧化物Fe2O3不能发生反应,所以沉淀M中除含有泥沙外,一定还含有Fe2O3;在滤液X中含有NaOH及NaAlO2、NaSiO3,向其中通入CO2气体,并控制反应条件,会发生反应:NaAlO2+CO2+2H2O=NaHCO3+Al(OH)3↓,将Al(OH)3沉淀洗涤,灼烧,发生分解反应:2Al(OH)3![]() Al2O3+3H2O,产生的沉淀N是Al2O3;
Al2O3+3H2O,产生的沉淀N是Al2O3;
(3)由于NaOH溶液过量,所以在滤液X中,含铝元素的溶质的化学式为NaAlO2;它是盐;
(4)由于Al(OH)3是两性氢氧化物,它既能与强酸发生反应,也能与强碱发生反应,所以在实验室里制取氢氧化铝时通常是往AlCl3溶液中加入弱碱氨水来制取Al(OH)3,该反应的离子方程式为Al3++3NH3·H2O=Al(OH)3↓+3NH4+;
(5)由于在滤液X中含有Na2SiO3,通入CO2气体时,形成的沉淀只有Al(OH)3,所以滤液Y中除了含有Na2CO3或NaHCO3外,一定还含有硅酸钠(或Na2SiO3)。


科目:高中化学 来源: 题型:
【题目】在探究新制饱和氯水成分的实验中,下列根据实验现象得出的结论不正确的是
A. 氯水使有色布条褪色,说明氯水中含有![]()
B. 向氯水中加入![]() 溶液产生白色沉淀,说明氯水中含有
溶液产生白色沉淀,说明氯水中含有![]()
C. 向氯水中加入![]() 粉末,有气泡产生,说明氯水中含有
粉末,有气泡产生,说明氯水中含有![]()
D. 向氢氧化钠溶液中滴加氯水,溶液黄绿色消失,说明氯水中含有![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼、磷元素在化学中有很重要的地位,硼、磷及其化合物广泛应用于开发新型储氢材料、超导材料、富燃料材料、复合材料等高新材料领域。回答下列问题。
(1)Ti(BH4)3是一种储氢材料,可由TiCl4和LiBH4反应制得.
①基态Ti3+的未成对电子数有___个。
②LiBH4由Li+和BH4-构成,BH4-呈正四面体构型。LiBH4中不存在的作用力有___(填标号)
A.离子键 B.共价键 C.金属键 D.配位键
(2)氨硼烷(NH3BH3)是一种新型储氢材料,其分子中存在配位键,则氨硼烷分子结构式为____,写出一种与氨硼烷互为等电子体的分子___(填化学式)。
(3)硼酸(H3BO3)是一种片层状结构白色晶体,层内的H3BO3分子间通过氢键相连[如图]。

读图分析1mol H3BO3的晶体中有___mol氢键。
(4)四(三苯基膦)钯分子结构如图:

P原子以正四面体的形态围绕在钯原子中心上,钯原子的杂化轨道类型为___;判断该物质在水中___(填写“易溶”或者“难溶”),并加以解释____。
(5)硼氢化钠是一种常用的还原剂。其晶胞结构如图所示:

①该晶体中Na+的配位数为___。
②已知硼氢化钠晶体的密度为ρg/cm3,NA代表阿伏伽德罗常数的值,则a=___(用含ρ、NA的最简式子表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】部分中学化学常见元素原子结构及性质如表所示
元素 | 结构及性质 |
A | A在第三周期中简单离子半径最小 |
B | B原子最外层电子数是内层电子数的 |
C | 使用最广泛的金属元素C能形成两种氯化物,其相对分子质量之差为35.5 |
D | D与B同主族,且通常状况下D没有正化合价 |
E | E在周期表中位于IA族,有人认为将其排在VIIA族也有一定道理 |
F | F与B同周期,其最高价氧化物的水化物与A或B的最高价氧化物的水化物均能反应 |
(1)C元素在周期表中的位置_____________;E形成的一种简单离子能支持“将E排在VIIA族”这一观点,该离子的结构示意图为_______________________。
(2)E与D可以按原子个数比2:1、1:1形成两种化合物X、Y,区别X、Y这两种物质的实验方法为________________________________。
E与B形成的一种化合物Z与X、Y中的一种电子总数相同且能发生化学反应,写出该反应的化学方程式__________________________(用相应化学式表示)
(3)请画出化合物F2B2的电子式__________,该化合物中含有的化学键类型是_______。
(4)将A、C的单质用导线连接后插入F的最高价氧化物的水化物溶液中可形成原电池,该原电池中阴离子移向_________(填“A”或“C”),写出该原电池总反应的离子方程式____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】烯烃在一定条件下发生氧化反应,碳碳双键断裂,如:![]() 被氧化为
被氧化为![]() 和
和![]()
![]() 、
、![]() 、
、![]() 、
、![]() 表示烃基或氢原子
表示烃基或氢原子![]() 。由此推断分子式为
。由此推断分子式为![]() 的烯烃所有可能的氧化产物有( )
的烯烃所有可能的氧化产物有( )
A. 5种B. 6种C. 7种D. 8种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化氯(ClO2)是一种黄绿色气体,易溶于水,在混合气体中的体积分数大于10%就可能发生爆炸,在工业上常用作水处理剂、漂白剂。回答下列问题:
(1)在处理废水时,ClO2可将废水中的CN-氧化成CO2和N2,写出该反应的离子方程式:____。
(2)某小组设计了如图所示的实验装置用于制备ClO2。
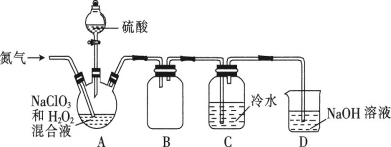
①通入氮气的主要作用有2个,一是可以起到搅拌作用,二是____。
②装置B的作用是____。
③装置A用于生成ClO2气体,该反应的离子方程式为____。
④当看到装置C中导管液面上升时应进行的操作是___。
(3)测定装置C中ClO2溶液的浓度:取10mLC中溶液于锥形瓶中,加入足量的KI溶液和H2SO4酸化,然后加入___作指示剂,用0.1000mol·L-1的Na2S2O3标准液滴定锥形瓶中的溶液(2ClO2+10I-+8H+=5I2+2Cl-+4H2O,I2+2S2O32-=2I-+S4O62-),测得标准液消耗的体积为20.00mL,通过计算可知C中ClO2溶液的浓度为___mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯酸是一种强酸,浓度超过40%时会发生分解,反应可表示为:a HClO3 = bO2↑+ c Cl2↑+ d HClO4 + e H2O。下列有关说法正确的是 ( )
A. 由反应可确定:氧化产物是HClO4
B. 由非金属性Cl>S,可推知酸性HClO3>H2SO4
C. 若化学计量数a=8,b=3,则该反应转移电子数为8e-
D. 若该反应所得lmol混合气体质量为45g,则反应可表示为:3HClO3 = 2O2↑+ C12↑+ HClO4 + H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)选择下列实验方法分离物质,将分离方法的序号填在横线上:a、萃取分液法;b、加热分解; c、结晶法; d、分液法; e、蒸馏法; f、过滤法; g、渗析法
①_____从硝酸钾和氯化钠的混合溶液中获得硝酸钾
②______分离水和苯的混合物
③_____除去氢氧化铁胶体中混有的NaCl
④______分离碘和四氯化碳
(2)实验室用4.0 mol/L NaCl溶液配制100mL 0.50 mol/L NaCl溶液。
①实验需要玻璃棒、胶头滴管、烧杯、量筒外,还需要的玻璃仪器是____________。
②配制上述溶液,需要4.0 mol/L NaCl溶液_________mL。
③配制过程中出现以下情况,使所配溶液浓度偏低_____________。
A.溶液转移后没有洗涤烧杯和玻璃棒。 B.定容时仰视容量瓶的刻度线。
C. 未冷却即进行转移、定容操作。 D.容量瓶中原有少量蒸馏水
E.如果加水超过了刻度线,取出溶液使液面恰好到刻度线。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将1.12 g铁粉加入25 mL 2 mol·L-1的氯化铁溶液中,充分反应后,其结果是
A. 铁粉有剩余,溶液呈浅绿色,Cl-基本保持不变B. Fe2+和Fe3+物质的量之比为5∶1
C. 往溶液中滴入无色KSCN溶液,显红色D. 氧化产物和还原产物的物质的量之比为2∶5
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com