
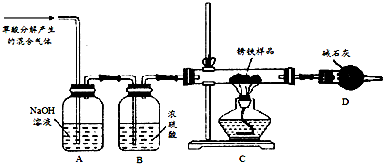
分析 草酸分解生成二氧化碳、一氧化碳和水,通过A中氢氧化钠溶液除去二氧化碳,通过B中浓硫酸吸收水蒸气,一氧化碳还原铁锈样品生成二氧化碳和铁,碱石灰吸收生成的二氧化碳,
(1)依据氧化还原反应和原子守恒分析产物,草酸分解生成一氧化碳、二氧化碳和水;
(2)根据浓硫酸吸收水和碱石灰吸收水和二氧化碳,求出二氧化碳的质量,然后根据二氧化碳求出氧化铁的质量,从而求出x的值;再根据样品总质量计算出m(Fe):m (Fe2O3•xH2O).
解答 解:(1)草酸(H2C2O4)分解产生CO等气体,依据元素化合价变化可知碳元素化合价+3甲变化为+2价,同时一定会有化合价升高到+4价,生成气体为二氧化碳,原子守恒得到氢元素生成水,反应的化学方程式为:H2C2O4$→_{△}^{浓硫酸}$CO↑+CO2↑+H2O,
故答案为:H2C2O4$→_{△}^{浓硫酸}$CO↑+CO2↑+H2O;
(2)浓硫酸吸收水,碱石灰吸收水和二氧化碳.取锈铁样品12.6g置于装置D的硬质玻璃管中,加热一段时间至完全反应后得到固体的质量为8.4g,装置D增重8.4g.若将装置D换成装浓硫酸的洗气瓶,重新按上述样品的用量和操作进行实验,若完全反应后得到固体的质量仍为8.4g,而装置E增重1.8g.所以水的质量为1.8g,二氧化碳的质量为8.4g-1.8g=6.6g,设氧化铁的质量为y,
Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2
160 132
y 6.6g
$\frac{160}{y}$=$\frac{132}{6.6}$,
y=8g
则氧化铁和水的分子个数比=$\frac{8g}{160}$:$\frac{1.8g}{18}$=1:2,所以x=2;
样品中铁的质量为:12.6g-(8g+1.8g)=2.8g,所以样品中铁单质和Fe2O3•xH2O的质量比为:2.8g:(8g+1.8g)=2:7,
故答案为:2;2:7.
点评 本题考查了探究物质组成及测量物质含量的方法、铁的氧化物的性质等,题目难度中等,注意掌握探究物质组成、测量物质含量常用方法,掌握基础是解题关键.


科目:高中化学 来源: 题型:选择题
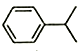
| A. | 异丙苯的分子式为C9H12 | |
| B. | 异丙苯能使酸性高锰酸钾溶液褪色 | |
| C. | 异丙苯中碳原子可能都处于同一平面 | |
| D. | 异丙苯的和苯为同系物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 22.4L氮气中含NA个氮原子 | |
| B. | 在标准状况下,1mol水的体积约为22.4L | |
| C. | 0.3 mol•L-1Na2SO4溶液中含0.6NA个Na+ | |
| D. | 18 g水中所含的氢原子数目为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若每消耗2n mol HI的同时生成n mol H2,表明该反应已达平衡 | |
| B. | 容器内的压强不发生变化,表明该反应已达平衡 | |
| C. | 平衡时,若其他条件不变,再充入一定量HI,重新达平衡后,I2的百分含量增大 | |
| D. | 平衡时,若其他条件不变,升高温度,混合气体的颜色加深 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
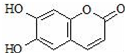
| A. | 与稀H2SO4混合加热不反应 | |
| B. | 不能使酸性高锰酸钾溶液褪色 | |
| C. | 1mol 瑞香素最多能与3mol Br2发生反应 | |
| D. | 1mol瑞香素与足量的NaOH溶液发生反应时,消耗NaOH 2mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液中可以同时含有Fe2+、NO3- | B. | 溶液中一定有OH-、Na+ | ||
| C. | 溶液中可能含有Na+、H+、Mg2+、NO3- | D. | 若X是AlO2-,则上述离子最多有2种 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com