
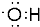 ;二氧化碳为直线型结构,分子中存在两个碳氧双键,二氧化碳的电子式为:
;二氧化碳为直线型结构,分子中存在两个碳氧双键,二氧化碳的电子式为: ;乙酸的官能团为羧基;丁烷的同分异构体为异丁烷,其结构简式为:CH3CH(CH3)2,
;乙酸的官能团为羧基;丁烷的同分异构体为异丁烷,其结构简式为:CH3CH(CH3)2,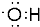 ;
; ;羧基;CH3CH(CH3)2;
;羧基;CH3CH(CH3)2; ,该反应为取代反应,
,该反应为取代反应, ;取代反应.
;取代反应.


 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案科目:高中化学 来源: 题型:
| A、滴定管只能用于滴定,不能用来量取溶液 |
| B、用浓氨水清洗附在试管壁上的银 |
| C、使用酒精灯的外焰加热温度高 |
| D、加热烘干试管时,其口应向上倾斜 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 物质结构[Cu(NH3)4]SO4?H2O是一种杀虫剂.
物质结构[Cu(NH3)4]SO4?H2O是一种杀虫剂.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com