
| A. | 1:1:1 | B. | 1:2:3 | C. | 6:3:2 | D. | 2:3:6 |
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化钠可用作漂白剂 | B. | 明矾可用作净水剂 | ||
| C. | 碳酸氢钠可用于治疗胃酸过多 | D. | 氧化铝可用来制造耐火坩埚 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NO3- K+[Al(OH)4]- OH- | B. | Na+ Ba2+ Mg2+ HCO3- | ||
| C. | NO3- Mg2+ K+ Cl- | D. | NH4+ NO3- CO32- Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
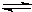 Fe(OH)3(胶体)+3H+.
Fe(OH)3(胶体)+3H+.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氧化硫具有还原性,可用二氧化硫水溶液吸收溴蒸气 | |
| B. | 氢氟酸具有强酸性,可用氢氟酸蚀刻玻璃 | |
| C. | 氨气具有氧化性,可用浓氨水检验氯气管道是否泄漏 | |
| D. | SiO2的导电能力强,可用于制造通讯光缆 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

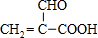
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com