
【题目】碳、氮、氧、氟、钙、铜等元素的化合物广泛存在于自然界,回答下列问题:
(1)将乙炔(C2H2)通入[Cu(NH3)2]Cl溶液生成Cu2C2红榇色沉淀。乙炔分子中σ键与π键个数比值为___________,Cu+基态核外电子排布式为___________,[Cu(NH3)2]Cl中化学键类型为___________。
(2)NF3是微电子工业中优良的等离子刻蚀气体。元素第一电离能N___________F(填“>”“<”或“=”),NF3中氮原子的杂化轨道类型为___________,NF3属于___________分子。(填“极性”或“非极性”)
(3)C60可以用作储氢材料。已知金刚石中C-C的键长为154.45pm,C60中C-C的键长为140~145pm,有同学据此认为C60的熔点高于金刚石,你认为是否正确?理由是___________。
(4)氮的氧化物和含氧酸在医疗上具有重要的应用。写出与N2O互为等电子体的分子___________(任写一种),酸性HNO3>HNO2,试着从结构上解释其原因___________。
(5)电石(CaC2)是有机合成化学工业的基本原料。CaC2晶体的晶胞结构与NaCl晶体相似(如图所示),但晶体中由于哑铃形C22-的存在,使晶胞沿一个方向拉长。CaC2晶体中每个Ca2+周围距离最近的C22-的数目为___________,已知CaC2晶体的密度为2.22g·cm-3,该晶胞的体积为___________cm3。

【答案】3:2 1s22s22p63s23p63d10或[Ar]3d10 离子键、共价键、配位键 < sp3 极性 不正确,金刚石是原子晶体,融化时需要破坏共价键,C60为分子晶体,融化时破坏分子间作用力,无需破坏共价键,所以C60熔点低于金刚石。 CO2或 CS2等 电负性O>N,-NO2中N的正电性大于-NO中的N,导致HO-NO2中O-H极性大于HO-NO中的O-H极性,因而在水分子作用下HO-NO2比HO-NO更容易电离出H+,即酸性HNO3>HNO2。 4 1.9×10-22
【解析】
本题考查的是物质结构和性质。
(1)乙炔中氢原子只有1个电子基态下处于能量最低1s轨道。而碳原子有6个电子,两个位于1s轨道,不参与成键,4个位于第二层上。当形成乙炔时,4个位于最外层的原子轨道发生杂化,即一个s轨道和一个p轨道杂化成两个sp轨道,另外的两个2p轨道保持不变。这样在形成乙炔时,碳原子的其中一个sp轨道与氢原子的1s轨道头碰头重叠,形成C-Hσ键,另一个sp轨道则与另一个碳原子的sp轨道头碰头重叠形成C-Cσ键。碳原子剩下的两个p轨道则肩并肩重叠形成两个C-Cπ键。所以乙炔中有3个σ键与2个π键。Cu为29号元素,Cu+基态核外电子排布式为1s22s22p63s23p63d10或[Ar]3d10 。[Cu(NH3)2]Cl中Cu+与NH3之间的化学键为配位键,N-H为极性共价键,[Cu(NH3)2]+与Cl-之间为离子键;
(2)同周期主族元素从左到右最外层电子的有效核电荷逐渐增大,电离能也逐渐增大,所以F元素的第一电离能比N元素的第一电离能大。N原子杂化轨道数目为4,采取sp3杂化。NF3分子构型与NH3相似,NH3分子构型是三角锥型,所以NF3分子构型也是三角锥型,三角锥型分子的结构不对称,正负电荷中心不重叠,为极性分子;
(3)金刚石是原子晶体,融化时需要破坏共价键,C60为分子晶体,融化时破坏分子间作用力,无需破坏共价键,所以C60熔点低于金刚石;
(4)符合等电子体的两条基本要求是:原子总数一致,价电子总数一致。二氧化碳、二硫化碳与一氧化二氮分子中都含有3个原子,其价电子总数是16,是等电子体;电负性O>N,-NO2中N的正电性大于-NO中的N,导致HO-NO2中O-H极性大于HO-NO中的O-H极性,因而在水分子作用下HO-NO2比HO-NO更容易电离出H+,即酸性HNO3>HNO2;
(5)依据晶胞示意图可以看出,晶胞的一个平面的长与宽不相等,再由图中体心可知1个Ca2+周围距离最近的C22-有4个,而不是6个,要特别注意题给的信息,CaC2晶体的晶胞结构与NaCl晶体的相似,该晶胞中含有Ca为12×14+1=4,一个晶胞中含有4个CaC2,CaC2晶体的密度为2.22g/cm3,该晶胞的体积为V=m/ρ=(4×64)÷(2.22×6.02×1023)≈1.92×1022cm3。据此解答。
(1)乙炔中氢原子只有1个电子基态下处于能量最低1s轨道。而碳原子有6个电子,两个位于1s轨道,不参与成键,4个位于第二层上。当形成乙炔时,4个位于最外层的原子轨道发生杂化,即一个s轨道和一个p轨道杂化成两个sp轨道,另外的两个2p轨道保持不变。这样在形成乙炔时,碳原子的其中一个sp轨道与氢原子的1s轨道头碰头重叠,形成C-Hσ键,另一个sp轨道则与另一个碳原子的sp轨道头碰头重叠形成C-Cσ键。碳原子剩下的两个p轨道则肩并肩重叠形成两个C-Cπ键。所以乙炔中有3个σ键与2个π键。Cu为29号元素,Cu+基态核外电子排布式为1s22s22p63s23p63d10或[Ar]3d10 。[Cu(NH3)2]Cl中Cu+与NH3之间的化学键为配位键,N-H为极性共价键,[Cu(NH3)2]+与Cl-之间为离子键。本小题答案为:3:2 ;1s22s22p63s23p63d10或[Ar]3d10;离子键、共价键、配位键。
(2)同周期主族元素从左到右最外层电子的有效核电荷逐渐增大,电离能也逐渐增大,所以F元素的第一电离能比N元素的第一电离能大。N原子杂化轨道数目为4,采取sp3杂化。NF3分子构型与NH3相似,NH3分子构型是三角锥型,所以NF3分子构型也是三角锥型,三角锥型分子的结构不对称,正负电荷中心不重叠,为极性分子。本小题答案为:<;sp3 ;极性。
(3)不正确,金刚石是原子晶体,融化时需要破坏共价键,C60为分子晶体,融化时破坏分子间作用力,无需破坏共价键,所以C60熔点低于金刚石。本小题答案为:不正确,金刚石是原子晶体,融化时需要破坏共价键,C60为分子晶体,融化时破坏分子间作用力,无需破坏共价键,所以C60熔点低于金刚石。
(4)符合等电子体的两条基本要求是:原子总数一致,价电子总数一致。二氧化碳、二硫化碳与一氧化二氮分子中都含有3个原子,其价电子总数是16,是等电子体;电负性O>N,-NO2中N的正电性大于-NO中的N,导致HO-NO2中O-H极性大于HO-NO中的O-H极性,因而在水分子作用下HO-NO2比HO-NO更容易电离出H+,即酸性HNO3>HNO2。本小题答案为:CO2或 CS2等;电负性O>N,-NO2中N的正电性大于-NO中的N,导致HO-NO2中O-H极性大于HO-NO中的O-H极性,因而在水分子作用下HO-NO2比HO-NO更容易电离出H+,即酸性HNO3>HNO2。
(5)依据晶胞示意图可以看出,晶胞的一个平面的长与宽不相等,再由图中体心可知1个Ca2+周围距离最近的C22-有4个,而不是6个,要特别注意题给的信息,CaC2晶体的晶胞结构与NaCl晶体的相似,该晶胞中含有Ca为12×14+1=4,一个晶胞中含有4个CaC2,CaC2晶体的密度为2.22g/cm3,该晶胞的体积为V=m/ρ=(4×64)÷(2.22×6.02×1023)≈1.92×1022cm3。本小题答案为:4;1.92×1022。


 阶梯计算系列答案
阶梯计算系列答案科目:高中化学 来源: 题型:
【题目】现有NaCl、Na2SO4和NaNO3的混合物,选择适当的试剂除去杂质,从而得到纯净的NaNO3晶体,相应的实验流程如图所示。

请回答下列问题:
(1)写出实验流程中下列物质的化学式:试剂X___,沉淀A____。
(2)上述实验流程中①②③步均要进行的实验操作是___(填操作名称)。
(3)上述实验流程中加入过量Na2CO3溶液的目的是______________________________。
(4)按此实验方案得到的溶液3中肯定含有______(填化学式)杂质。为了解决这个问题,可以向溶液3中加入适量的___(填化学式),之后若要获得NaNO3晶体,需进行的实验操作是____(填操作名称)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近几年地球发生地震灾害较多,抢救地震后被困在废墟下的伤员,首要的措施是给伤员补充能量。下图是医院给伤员输液时用的一瓶质量分数为5%的葡萄糖(C6H12O6)注射液标签,请认真观察标签上所列的内容后填写:

(1)葡萄糖的摩尔质量为________;
(2)该溶液中含水________ g;
(3)该溶液的物质的量浓度为________ mol/L(精确到小数点后面两位)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素x、y、d、f的最高正价或最低负价、原子半径的相对大小随原子序数的变化如图所示;短周期元素z、e、g、h的最高价氧化物对应水化物的溶液(浓度均为001mol/L)的pH与原子序数的关系如图所示:

下列有关说法正确的是
A. 离子半径大小顺序:e>f>g>h
B. 由x、z、d三种元素形成的化合物中一定不含离子键
C. y、d、g的简单气态氢化物中沸点最高的是g的氢化物
D. 装满zd2气体的小试管倒扣水槽中充分反应,试管液面上升约2/3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜阳极泥(主要含有铜、银、金、少量的镍)是有色金属冶炼过程中重要的“二次资源”。其合理处理对于实现资源的综合利用具有重要意义。一种从铜阳极泥中分离提取多种金属元素的工艺流程如下:

已知:分金液的主要成分为[AuCl4]-;分金渣的主要成分为AgCl;分银液中主要成分为[Ag(SO3)2]3-,且存在[Ag(SO3)2]3-=Ag++2SO32-
(1)“分铜”时,单质铜发生反应的化学方程式为___________,已知“分铜”时各元素的浸出率如下表所示。

“分铜”时加入足量的NaC1的主要作用为______________________。
(2)“分金”时,单质金发生反应的离子方程式为______________________。
(3)Na2SO3溶液中含硫微粒物质的量分数与pH的关系如图所示。

“沉银”时,需加入硫酸调节溶液的pH=4,分析能够析出AgC的原因为___________。调节溶液的pH不能过低,理由为___________。
(4)已知离子浓度≤10-5mol/L时,认为该离子沉淀完全。已知: Ksp[Pb(OH)2]=2.5×10-16,Ksp[Sb(OH)3]=10-41。浸取“分银渣”可得到含0.025 mol/L Pb2+的溶液(含少量Sb3+杂质)。欲获得较纯净的Pb2+溶液,调节PH的范围为___________。(忽略溶液体积变化)
(5)工业上,用镍为阳极,电解0.1 mol/L NiCl2溶液与一定量NH4Cl组成的混合溶液,可得高纯度的球形超细镍粉。当其他条件一定时,NH4Cl的浓度对阴极电流效率及镍的成粉率的影响如图所示:

为获得髙纯度的球形超细镍粉,NH4Cl溶液的浓度最好控制为___________g/L,当NH4Cl溶液的浓度大于15g/L时,阴极有无色无味气体生成,导致阴极电流效率降低,该气体为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在标准状况下,33.6LN2的物质的量为_____mol,其分子数为_______。
(2)0.4mol某气体的体积为9.8L,则该气体的摩尔体积为____,气体所处的条件____(填“是”或者“不是”)标准状况。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学在生活中有着广泛的应用,下列说法正确的是( )
A.硅胶可用作袋装食品、瓶装药品的干燥剂
B.在医疗上碳酸钠、Al(OH)3均可用于治疗胃酸过多
C.自来水中加入少量明矾,生成的胶体可以起到杀菌消毒的作用
D.人造刚玉的熔点很高,可用作高级耐火材料,其主要成分是SiO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示a、b都是惰性电极,通电一段时间后,a极附近溶液显红色。下列说法中正确的是( )
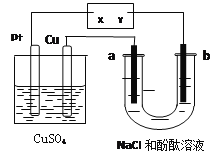
A. X是正极,Y是负极 B. U型管中溶液PH值逐渐变小
C. CuSO4溶液的pH逐渐减小 D. CuSO4溶液的pH保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素W、X、Y、Z的原子序数依次增大,它们的原子最外层电子数总和等于Z的原子序数,由这四种元素组成一种化合物M具有如下性质下列推断正确的是

A. 原子半径:Z>Y>X>W
B. 最高价氧化物对应的水化物酸性:Y>X
C. 简单阴离子的还原性:W<Z
D. W、Y、Z组成的化合物只含共价键
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com