

| 反应时间/min | n(CO)/mol | H2O/mol |
| 0 | 1.20 | 0.60 |
| t1 | 0.80 | |
| t2 | 0.20 |
分析 (1)保持其他条件不变,增加一种反应物的浓度,平衡向正反应方向移动,另一种反应物的转化率增大,自身转化率降低;
CO与H2O按物质的量比1:1反应,充入0.60 mol CO和1.20 mol H2O与充入1.20 mol CO和0.6mol H2O到达平衡时对应生成物的浓度、物质的量相同;
t1min时n(CO)=0.8mol,n(H2O)=0.6mol-0.4mol=0.2mol,t2min时n(H2O)=0.2mol,说明t1min时反应已经达到平衡状态,反应前后气体的体积不变,利用物质的量代替浓度计算700℃时平衡常数,比较不同温度下的平衡常数大小判断反应的热效应;
(2)氯碱工业中电解饱和食盐水制备氢气,电解饱和食盐水生成氢氧化钠、氢气和氯气;
(3)HI分解是可逆反应,分离出氢气有利于平衡正向移动;
(4)依据热化学方程式和盖斯定律计算得到所需热化学方程式;
(5)阴极发生还原反应,CO2被还原生成CO,总反应式减去阳极反应式得阴极反应式.
解答 解:(1)保持其他条件不变,向平衡体系中再通入0.20molH2O,与原平衡相比,平衡向右移动,达到新平衡时CO转化率增大,H2O转化率减小,H2O的体积分数会增大;
t1min时n(CO)=0.8mol,n(H2O)=0.6mol-0.4mol=0.2mol,t2min时n(H2O)=0.2mol,说明t1min时反应已经达到平衡状态,此时n(CO)=0.8mol,n(H2O)=0.2mol,n(CO2)=c(H2)=△n(CO)=1.2mol-0.8mol=0.4mol,反应前后气体的体积不变,利用物质的量代替浓度计算700℃时平衡常数,则k=$\frac{0.4×0.4}{0.8×0.2}$=1,温度升至800℃,上述反应平衡常数为0.64,说明温度升高,平衡是向左移动,故正反应为放热反应;
CO与H2O按物质的量比1:1反应,充入0.60 mol CO和1.20 mol H2O与充入1.20 mol CO和0.6mol H2O,平衡时生成物的浓度对应相同,t1min时n(CO)=0.8mol,n(H2O)=0.6mol-0.4mol=0.2mol,t2min时n(H2O)=0.2mol,说明t1min时反应已经达到平衡状态,根据化学方程式可知,则生成的n(CO2)=0.40mol;
故答案为:增大; 增大; 放热; 0.40 mol;
(2)氯碱工业中电解饱和食盐水制备氢气,电解饱和食盐水生成氢氧化钠、氢气和氯气,反应的离子方程式为:2Cl-+2H2O $\frac{\underline{\;电解\;}}{\;}$2OH-+H2↑+Cl2↑;
故答案为:2Cl-+2H2O $\frac{\underline{\;电解\;}}{\;}$2OH-+H2↑+Cl2↑;
(3)HI分解为可逆反应,及时分离出产物H2,有利于反应正向进行;
故答案为:减小氢气的浓度,使HI分解平衡正向移动,提高HI的分解率;
(4)①C(s)+H2O(g)?CO(g)+H2(g),△H=a kJ•mol-1
②CO(g)+H2O(g)?CO2(g)+H2(g),△H=b kJ•mol-1
依据盖斯定律计算①-②得到:C(s)+CO2(g)=2CO(g),△H=(a-b)kJ•mol-1;
故答案为:(a-b)kJ•mol-1;
(5)总反应式为2CO2=2CO+O2,阳极反应为4OH--4e-=O2↑+2H2O,总反应式减去阳极反应式得阴极反应式,所以阴极反应为:2CO2+4e-+2H2O=2CO+4OH-,
故答案为:2CO2+4e-+2H2O=2CO+4OH-.
点评 本题主要考查化学反应速率、化学平衡及平衡常数等计算,电解原理分析,热化学方程式和盖斯定律计算应用,注意数据的规律分析利用,掌握基础是哦关键,题目难度中等.


科目:高中化学 来源: 题型:解答题
| 氢氧化钠质量(g) | 氯化钠质量(g) | |
| ① | 2.40 | 3.51 |
| ② | 2.32 | 2.34 |
| ③ | 3.48 | 3.51 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
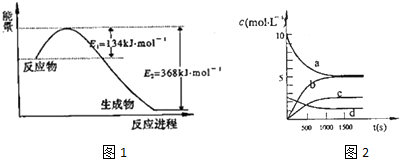
| t(s) | 0 | 500 | 1000 | 1500 |
| n(NO2)(mol) | 20 | 13.96 | 10.08 | 10.08 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
| 一 | ① | ||||||
| 二 | ② | ③ | ④ | ||||
| 三 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ | |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 小于12.5% | B. | 等于12.5% | C. | 大于12.5% | D. | 无法估计 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com