
| n(SO32-):n(HSO3-) | 91:9 | 1:1 | 9:91 |
| pH | 8.2 | 7.2 | 6.2 |
分析 (1)标况下44.8L二氧化硫的物质的量为2mol,氢氧化钠为3mol,则溶质为亚硫酸钠和亚硫酸氢钠的混合物;
(2)①由表格中的数据可知,HSO3-越多,酸性越强,说明亚硫酸氢根离子的电离程度大于其水解程度;
②HSO3-电离程度大于水解程度导致溶液呈酸性,因为亚硫酸氢根离子既能电离又能水解,所以溶液中存在H2SO3、SO32-,在NaHSO3溶液中存在电荷守恒和物料守恒,根据电荷守恒和物料守恒判断;
③吸收液呈中性时,溶质为亚硫酸钠和亚硫酸氢钠,电离与水解的程度相等,结合电荷守恒解答.
解答 解:(1)标况下44.8L二氧化硫的物质的量为:$\frac{44.8L}{22.4L/mol}$=2mol,而NaOH为3mol,根据反应2OH-+SO2═SO32-+H2O、OH-+SO2═HSO3-可知,反应生成亚硫酸钠和亚硫酸氢钠的混合物,
故答案为:Na2SO3、NaHSO3;
(2)①由表格中的数据可知,HSO3-越多,酸性越强,亚硫酸氢根离子的电离方程式为:HSO3-?H++SO32-,显酸性是因其电离大于其水解,
故答案为:酸;HSO3-=H++SO32-、HSO3-+H2O=H2SO3+OH-,因为HSO3-电离大于水解,所以显酸性;
②钠离子不水解,HSO3-电离程度大于水解程度导致溶液呈酸性,水也电离生成氢离子和氢氧根离子,所以溶液中离子浓度大小顺序是c(Na+)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-),
故答案为:c(Na+)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-);
③吸收液呈中性时,溶质为亚硫酸钠和亚硫酸氢钠,电离与水解的程度相等,
a.由电荷守恒可知,c(H+)+c(Na+)═2c(SO32-)+c(HSO3-)+c(OH-),中性溶液则c(H+)═c(OH-),则c(Na+)═2c(SO32-)+c(HSO3-),故a正确;
b.SO32-+H2O?HSO3-+OH-,HSO3-?H++SO32-,亚硫酸两步水解,则离子浓度为c(Na+)>c(HSO3-)>c(SO32-)>c(H+)=c(OH-),故b正确;
c.c(Na+)+c(H+)═c(SO32-)+c(HSO3-)+c(OH-)中不遵循电荷守恒,正确的电荷守恒为:c(Na+)+c(H+)═2c(SO32-)+c(HSO3-)+c(OH-),故c错误;
故答案为:ab.
点评 本题考查了酸碱混合的定性判断、离子浓度定性比较,题目难度中等,明确反应后溶质组成为解答关键,注意掌握电荷守恒、物料守恒及盐的水解原理在判断离子浓度大小中的应用方法.


科目:高中化学 来源: 题型:解答题
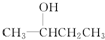 D.
D.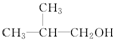 E.
E.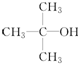
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
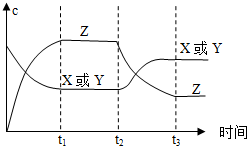 已知X(g)+Y(g)?2Z(g)△H<0.反应发生后,t1时达到平衡,t2时改变条件,t3时达到新平衡,则t2时改变的条件是下列说法中正确的是( )
已知X(g)+Y(g)?2Z(g)△H<0.反应发生后,t1时达到平衡,t2时改变条件,t3时达到新平衡,则t2时改变的条件是下列说法中正确的是( )| A. | 升高温度 | B. | 减小Z的浓度 | C. | 增大压强 | D. | 增大X或Y的浓度 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ②⑤ | C. | ②③⑤ | D. | ②③④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学反应中的能量变化通常表现为热量的变化 | |
| B. | 吸热反应一定需要加热的条件 | |
| C. | 化学键的断裂和形成是化学反应中能量变化的主要原因 | |
| D. | 反应物和生成物总能量的相对大小决定化学反应放出还是吸收能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 下表是元素周期表的一部分,根据①~⑧在周期表中的位置按题目要求回答:
下表是元素周期表的一部分,根据①~⑧在周期表中的位置按题目要求回答:| 族 周期 | IA | 0 | ||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 丙炔分子中不存在非极性键 | |
| B. | 丙炔分子中3个碳原子都是sp3杂化 | |
| C. | 丙炔分子中所有的原子都在同一直线上 | |
| D. | 丙炔分子中σ键与π键的个数比为3:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 从氟到碘,其氢化物的稳定性逐渐减弱 | |
| B. | 氧与硫为同主族元素,氧比硫的原子半径小,氧比硫的非金属性强 | |
| C. | 第三周期从钠到氯,最高价氧化物的水化物碱性逐渐减弱,酸性逐渐增强 | |
| D. | 因为铝原子比钠原子失去电子数目多,所以铝比钠的还原性强 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com