
【题目】电解合成 1 , 2-二氯乙烷的实验装置如图所示。下列说法中正确的是

A. 该装置工作时,化学能转变为电能
B. CuCl2能将C2H4还原为 l , 2-二氯乙烷
C. X、Y依次为阳离子交换膜、阴离子交换膜
D. 该装置总反应为CH2CH2 + 2H2O + 2NaCl![]() H2 + 2NaOH + ClCH2CH2Cl
H2 + 2NaOH + ClCH2CH2Cl
【答案】D
【解析】
A. 该装置为外加电源的电解池原理;
B. 根据装置图易知,阳极生成的CuCl2与C2H4发生了氧化还原反应,根据化合价的升降判断该氧化还原反应的规律;
C. 根据电解池阴阳极发生的电极反应式及溶液电中性原则分析作答;
D. 根据具体的电解反应与氧化还原反应综合写出该装置的总反应。
A. 该装置为电解池,则工作时,电能转变为化学能,故A项错误;
B. C2H4中C元素化合价为-2价,ClCH2CH2Cl中C元素化合价为-1价,则CuCl2能将C2H4氧化为1,2一二氯乙烷,故B项错误;
C. 该电解池中,阳极发生的电极反应式为:CuCl - e- + Cl-= CuCl2,阳极区需要氯离子参与,则X为阴离子交换膜,而阴极区发生的电极反应式为:2H2O + 2e- = H2↑+ 2OH-,有阴离子生成,为保持电中性,需要电解质溶液中的钠离子,则Y为阳离子交换膜,故C项错误;
D. 该装置中发生阳极首先发生反应:CuCl - e- + Cl-= CuCl2,生成的CuCl2再继续与C2H4反应生成1,2一二氯乙烷和CuCl,在阳极区循环利用,而阴极水中的氢离子放电生成氢气,其总反应方程式为:CH2=CH2+2H2O+2NaCl![]() H2+2NaOH+ClCH2CH2Cl,故D项正确;
H2+2NaOH+ClCH2CH2Cl,故D项正确;
答案选D。


科目:高中化学 来源: 题型:
【题目】金是一种用途广泛的贵重金属。某化工厂利用氰化法从一种含金矿石中提取金的工艺流程如下:
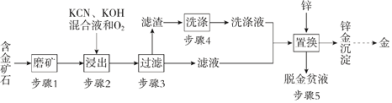
资料:
① Zn + ![]() O2 + H2O = Zn(OH)2
O2 + H2O = Zn(OH)2
② Zn2+(aq) ![]() Zn(CN)2(s)
Zn(CN)2(s) ![]() Zn(CN)42-(aq)
Zn(CN)42-(aq)
(1)步骤2中发生的反应有:
① 2Au(s) + 4CN-(aq) + 2H2O(l) + O2(g) = 2Au(CN)2-(aq) + 2OH-(aq) + H2O2(aq) H = -197.61 kJ·mol-1
② 2Au(s) + 4CN-(aq)+ H2O2(aq) = 2Au(CN)2-(aq) + 2OH-(aq) H = -386.93 kJ·mol-1
则2Au(s)+ 4CN-(aq)+ H2O(l) + 1/2O2(g) = 2Au(CN)2-(aq) + 2OH-(aq)的H =_______。
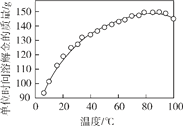
(2)下图是步骤2中金的溶解速率与温度的关系。80℃以后溶解速率降低的原因是___________。
(3)步骤4的目的是_________________。
(4)步骤5置换的总反应是:
2Au(CN)2- + 3Zn + 4CN- + 2H2O = 2Au + 2Zn(CN)42- + ZnO22- + 2H2↑
则以下说法正确的是________(填字母序号)。
A 步骤5进行时要先脱氧,否则会增加锌的用量
B 若溶液中c(CN-)过小,会生成Zn(CN)2,减缓置换速率
C 实际生产中加入适量Pb(NO3)2的目的是形成原电池加快置换速率
(5)脱金贫液(主要含有CN-)会破坏环境,影响人类健康,可通过化学方法转化为无毒废水净化排放。碱性条件下,用Cl2将贫液中的CN-氧化成无毒的CO2和N2,该反应的离子方程式为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物H是某些姜科植物根茎的提取物,具有抗肿瘤、抗菌、抗氧化等功效,其一种合成路线如下:

已知:i 质谱图显示有机物D的最大质荷比为94,且D遇FeCl3溶液显紫色
ii RMgBr+R′CHO→![]()
回答下列问题:
(1)D的化学式为___________;B的名称为___________。
(2)反应①的反应类型是___________:I中所含官能团的名称为___________。
(3)反应④的化学方程式是______________________。
(4)X是H的同系物,其相对分子质量比H小14,则X的同分异构体中,符合下列条件的有___________种(不含立体异构)
a.属于芳香族化合物 b.能发生水解反应 c.能发生银镜反应
其中核磁共振氢谱有4组峰,且峰面积之比为6:2:1:1的结构简式是___________(写一种即可)。
(5)补充完成由甲苯和丙醛为原料,制备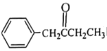 的合成路线(无机试剂任选)
的合成路线(无机试剂任选) ____________
____________ 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下述实验不能达到预期实验目的是( )
序号 | 实验内容 | 实验目的 |
A | 将2.5gCuSO4.5H2O溶解在97.5g水中 | 配制质量分数为1.6%的CuSO4溶液 |
B | 向盛有1mL硝酸银溶液的试管中滴加NaCl溶液,至不再有沉淀生成,再向其中滴加Na2S溶液 | 说明一种沉淀能转化为另一种溶解度更小的沉淀 |
C | 室温下,用pH试纸测定浓度为0.1mol.L-1NaClO溶液和0.1mol?L-1CH3COONa溶液的pH | 比较HClO和CH3COOH的酸性强弱 |
D | 室温下,分别向2支试管中加入相同体积、相同浓度的Na2S2O3溶液,再分别加入相同体积不同浓度的稀硫酸 | 研究浓度对反应速率的影响 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA代表阿伏加德罗常数的值。下列说法正确的是
A. 常温常压下,36g18O2中所含的中子数为16NA
B. 8.0 g Cu2S和CuO的混合物中含有的铜原子数为0.1NA
C. 电解饱和食盐水时,阳极生成22.4L气体时,转移的电子数为2NA
D. 室温下向1LpH=1的醋酸溶液中加水,所得溶液中H+数目小于0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知化学反应A2(g)+B2(g)===2AB(g)的能量变化如图所示,判断下列叙述中正确的是

A. 每生成2分子AB吸收b kJ热量
B. 该反应热ΔH=+(a-b) kJ·mol-1
C. 该反应中反应物的总能量高于生成物的总能量
D. 断裂1 mol A—A和1 mol B—B键,放出a kJ能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)写出下列物质的电离方程式:① HCl=_____,② NaOH=___,③ NaCl =_______,④ H2SO![]() =____。
=____。
(2)选择下列实验方法分离物质,将分离方法的字母填在横线上。
A.萃取分液法 B.加热分解 C.结晶法 D.分液法 E.蒸馏法 F.过滤法
①________分离饱和食盐水和沙子的混合物;
②________从硝酸钾和氯化钠的混合溶液中获得硝酸钾;
③________分离水和汽油的混合物;
④________分离四氯化碳(沸点为76.75 ℃)和甲苯(沸点为110.6 ℃)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知NaHSO3溶液显酸性,溶液中存在以下平衡:HSO3-+H2O![]() H2SO3+OH- ① HSO3-
H2SO3+OH- ① HSO3-![]() H++SO32- ②向 0.1 mol·L-1的NaHSO3溶液中分别加入以下物质,下列有关说法正确的
H++SO32- ②向 0.1 mol·L-1的NaHSO3溶液中分别加入以下物质,下列有关说法正确的
A. 加入少量金属 Na,平衡①左移,平衡②右移,溶液中 c(HSO3-)增大
B. 加入少量NaOH溶液,c(SO32-)/c(HSO3-)、c(OH-)/c(H+)的值均增大
C. 加入少量Na2SO3 固体,则 c(H+)+c(Na+)=c(HSO3-)+c(OH-)+1/2c(SO32-)
D. 加入氨水至中性,则 2c(Na+)=c(SO32-)>c(H+)=c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将纯锌片和纯铜片按图示方式插入同浓度的稀硫酸中一段时间。以下叙述正确的是( )

A. 两烧杯中铜片表面均有气泡产生
B. 甲烧杯中的电流与阳离子流向均为Zn→Cu
C. 两烧杯中溶液的pH均增大
D. 两烧杯在相同时间内转移电子数相等
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com