
| A、A的转化率变大 |
| B、平衡向正反应方向移动 |
| C、D的体积分数变大 |
| D、a<c+d |


 优生乐园系列答案
优生乐园系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
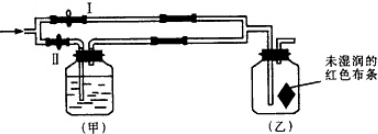
| A、浓H2SO4 |
| B、NaCl溶液 |
| C、Ba(OH)2溶液 |
| D、NaOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
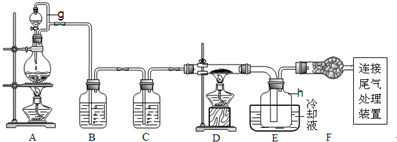
| 物质 | SiCl4 | BCl3 | AlCl3 | FeCl3 | PCl5 |
| 沸点/℃ | 57.7 | 12.8 | - | 315 | - |
| 熔点/℃ | -70.0 | -107.2 | - | - | - |
| 升华温度/℃ | - | - | 180 | 300 | 162 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、c+2a | ||
B、
| ||
| C、0<x<c | ||
| D、c<x<c+2a |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
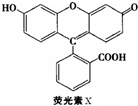
| A、荧光素的分子式为C20H14O5 |
| B、1molX最多能与9mol氢气反应 |
| C、1molX与足量的浓溴水反应,最多消耗4molBr2 |
| D、X能与甲醛发生缩聚反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| [H+]?[CH3COO-] |
| [CH3COOH] |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com