
����Ŀ����������Ϣ��Ƭ��ͼ��ʾ��

(1)���ԭ������Ϊ81������Ԫ�����ڱ���λ�ڵ�________���ڣ���________�塣
(2)�����ƶ���ȷ����________��
A�����ʵĻ�ԭ�ԣ�Tl��Al
B��ԭ�Ӱ뾶��Al��Tl
C�����ԣ�Al(OH)3��Tl(OH)3
D�������ԣ�Tl3����Al3��
(3)��(Tl)��ij�������ϵ����Ԫ��֮һ��Tl3����Ag�����Խ����з�����Ӧ��Tl3����2Ag===Tl����2Ag���������ƶ���ȷ����________��
A��Tl���������1������
B��Tl���γɣ�3�ۺͣ�1�۵Ļ�����
C��Tl3���������Ա�Ag����
D��Tl���Ļ�ԭ�Ա�Agǿ
���𰸡�(1)6 ��A (2)A (3)B
��������(1)�ƶ�Tl��Ԫ�����ڱ��е�λ�ã������ø����ڵ�Ԫ��������(2��8��8��18��32)���з�����81��2��8��8��18��18��27��������֪��Ԫ��λ�ڵ�6���ڣ���6��������ϵ��15��Ԫ��ռһ������27��14��13������Ԫ�����ڱ��Ľṹ��֪����13����Ϊ�ڢ�A�壬��Tl��Ԫ�����ڱ��е�λ��Ϊ��6���ڵڢ�A�塣
(2)ͬ����������£�Ԫ�ؽ���������ǿ�����ʻ�ԭ����ǿ��ԭ�Ӱ뾶�������������Լ�����������ǿ��
(3)��λ�ڵڢ�A�壬˵����ԭ���������3�����ӣ���Tl����������������ӣ�A������Tl3����2Ag===Tl����2Ag��֪��Tl3���������Ա�Ag��ǿ��Ag�Ļ�ԭ�Ա�Tl��ǿ��C��D����



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ʽ̼��þ���������ࡢҽҩ��ױƷ�ȹ�ҵ����ѧʽΪ4MgCO3��Mg��OH��2��5H2O��ij��ʽ̼��þ�к���SiO2���ʣ�Ϊ�ⶨ�䴿�ȡ�ij��ȤС���������������������
����I��
ȡһ����������Ʒ���������ַ�Ӧ��ͨ���ⶨCO2���������㴿��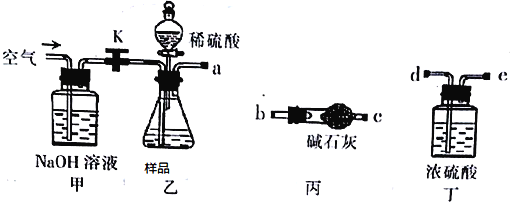
(1)���з�����Ӧ�ķ���ʽΪ______________________________ ��
(2)�����ӿڵ�����˳��Ϊ(װ�ÿ����ظ�ʹ��) a__________������������_________��
(3)�ر�ֹˮ��K������Ʒ�м���������ϡ���ᣬ����Ʒ��ַ�Ӧ���Ϊ�˲ⶨȷ��Ӧ���еIJ�����______________________________��
������
�ٳ�ȡ��ʽ̼��þ��Ʒmg���ڽ���Ʒ��ָ������գ���ȴ����������ظ������ڣ����ʣ���������Ϊm1g(��������ƽ����)��
(4)���������У��÷��������õ�����____________��
(5)��ͬѧ��Ϊ������������յĹ����лᷢ��MgCO3+SiO2![]() MgSiO3+CO2���ᵼ�²ⶨ�����������Ϊ��λͬѧ�Ĺ۵��Ƿ���ȷ_____�������ȷ��������˵���Լ������ɣ�______________________��
MgSiO3+CO2���ᵼ�²ⶨ�����������Ϊ��λͬѧ�Ĺ۵��Ƿ���ȷ_____�������ȷ��������˵���Լ������ɣ�______________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�о��Կ���С�������������Һ��ϡ�����кͷ�Ӧ���й����⣬����������̽����
I����1����ͬѧΪ��֤������������Һ��ϡ�����ܹ�������Ӧ����Ʋ������ͼ 1��ʾʵ�飬�� X��Һ��_____________��
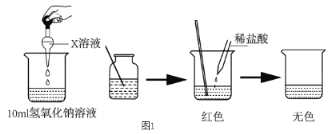
��2����ͬѧ�ô�����̽��ϡ NaOH ��Һ��ϡ���ᷴӦ�������¶Ⱥ� pH�ı仯���ⶨ�����ͼ2��ʾ��ͨ��������֪��ϡ NaOH ��Һ��ϡ���ᷴӦ��__________���ų��������ա���������30s ʱ����Һ�е�����Ϊ _____________��д��ѧʽ��
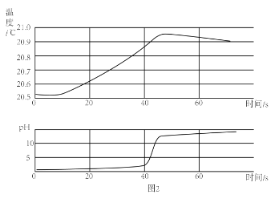
II����ͬѧΪ����֤����ʵ�飬Ҳ���������ij����������Һ�У����������ݲ���������Ϊ������������Һ�Ѿ����ʣ�����ԭ���û�ѧ����ʽ�ɱ�ʾΪ ____________________��
III:Ϊ�˲ⶨ������������Һ��̼���Ƶ�������������ͬѧ�������ͼ3��ʾ��ʵ��װ�á���֪��Һ©����װ�� 10%��ϡ���ᣬװ�����Լ���������
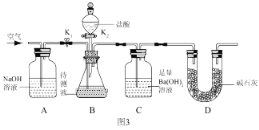
��ʵ�鲽�裩
�ٰ���ͼ 3 ���Ӻ�װ�ú����װ�������ԣ�
�ڹر� K1 �� K2���� B װ���м��� 100.0g������������Һ��Ʒ������ԭװ���ڿ�����CO2��ʵ���Ӱ�죩��
�۴� K2������ƿ�ڵμ����ᣬֱ�� B �в��ٲ�������Ϊֹ��
�ܴ� K1 �ر� K2��ͨ��һ��ʱ���������װ�� C �в��ٲ�������Ϊֹ��
�ݽ�װ�� C �еĹ�Һ�������ˡ�ϴ�ӡ���ɺ�Ƶù�������Ϊ 5.0g��
��ʵ����������ݴ�����
��A װ�õ������� ____________________��
����ȱ�ٲ���ܣ���ⶨ����� __________���ƫ����ƫС�����䡱����
������ʵ�����ݣ����������������Һ��̼���Ƶ���������Ϊ 5.3%��
��ʵ�鷴˼��
���и����ʩ�У�����߲ⶨȷ�ȵ��� __________������ĸ��
A�������μ�ϡ����
B����װ�� A��B ֮������ʢ��Ũ�����ϴ��ƿ
C����װ�� B��C ֮������ʢ�б��� NaHCO3 ��ϴ��ƿ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ѧС�鹹�뽫����β��(NO��NO2)ת��Ϊ��Ҫ�Ļ���ԭ��HNO3����ԭ����ͼ��ʾ������A��BΪ�������ϡ�����˵��һ����ȷ���ǣ� ��

A. �õ�ع���ʱ�����ӵ��������·��A��B���ڵ�·��B��A�γɱպϻ�·
B. �缫B������HNO3Ũ������
C. A�缫�ķ�ӦΪ��NO2��e����H2O==NO3-��2H�� NO��3e����2H2O===NO3-��4H��
D. �õ�ع���ʱ��ÿ����11.2LO2(��״����)�����Գ�ȥ��1molNO��NO2�Ļ��β��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʪ����п������ͭ�������������ӵ��������£�

��֪��ͭ������Ҫ��п��ͭ�������ӣ�Cd�����ܣ�Co���ȵ��ʡ�
�±��г�����ؽ������������������������pH����ʼ������pH����������Ũ��Ϊ0.1 mol��L-1���㣩��
�������� | Fe(OH)3 | Fe(OH)2 | Cd(OH)2 | Mn(OH)2 |
��ʼ������pH | 1.5 | 6.5 | 7.2 | 8.2 |
������ȫ��pH | 3.3 | 9.9 | 9.5 | 10.6 |
��1��Ϊ�����ͭ�������������ʣ��ɲ�ȡ�Ĵ�ʩ�У����ʵ������¶ȣ��ڽ��裻��______�ȡ���֪�����Ľ������Ӿ�Ϊ���ۣ�д�������ܵĻ�ѧ����ʽ__________________��
��2�����ܵĹ����У���Ҫ������Sb2O3��п�ۻ���Sb2O3��Co2+����Һ�γ���ز������Ͻ�CoSb������ص�������ӦʽΪ________________________________��
��3�������Ĺ��̷��������У�
���ȼ�������KMnO4��������Ӧ�����ӷ���ʽΪ______________________________��
���ټ���ZnO���Ʒ�ӦҺ��pH��ΧΪ_____________��
��4���������̵ڢٲ���������KMnO4ʱ�������Ʋ�����MnO2�������Ӧ����ɵĽ����______________���������KMnO4����������������Һ����FeԪ�ز��ࡣ�����ʵ�鷽��������֤_________________��
��5�����������Һ�ö��Ե缫���ɻ���ӵ��ʡ�����Һ�п�ѭ�����õ�������____��
��6���������ӷ�ˮ���û�ѧ�������������Ǽ����ӵ����ܻ�������ܶȻ�������25������
Ksp(CdCO3)��5.210��12�� Ksp(CdS)��3.610��29��Ksp(Cd(OH)2)��2.010��16������������Ϣ��
����Cd2+Ч����ѵ��Լ���____________��
a��Na2CO3 b��Na2S c��CaO
��������ʯ�Ҵ������ӷ�ˮ���pHΪ11����ʱ��Һ��c(Cd2+)��_________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾ��A��ͨ�����Cl2���ر�Bʱ��C���ĺ�ɫ��������������B��C����ɫ��������ɫ����D��װ����(����)
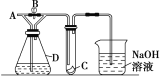
A. ŨH2SO4 B. NaOH��Һ
C. Ũ���� D. ����NaCl��Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������������ԡ���ɫ�����¸���ϲ���������ɫʳƷ����ɫ���ϡ���ɫ��Դ����ɫ��ѧ�ȣ�����ġ���ɫ���Ƕ��������ɳ�����չս�Ե�����������ɫ��ѧ��Ҫ��Ӿ��á������ͼ�������ƿ��еĻ�ѧ��Ӧ���ݴˣ��ɵ���þ������þ�������ĸ������У�����Ϊ���ж��ҷ��ϡ���ɫ��ѧ��Ҫ��ķ�����( )
A.Mg![]() Mg(NO3)2
Mg(NO3)2
B.Mg![]() MgCl2
MgCl2![]() Mg(OH)2
Mg(OH)2![]() Mg(NO3)2
Mg(NO3)2
C.Mg![]() MgO
MgO![]() Mg(NO3)2
Mg(NO3)2
D.Mg![]() MgSO4
MgSO4![]() Mg(NO3)2
Mg(NO3)2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ȼ���ͭ(CuCl)�������л��ϳɹ�ҵ�еĴ�������һ�ְ�ɫ��ĩ������ˮ���������Ҵ���ϡ���ᡣ��ҵ��������ӡˢ��·�ķ�Һ(��Fe3����Cu2����Fe2����Cl��)����CuCl��������ͼ��ʾ��
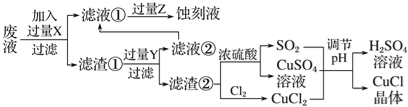
����������Ϣ�ش��������⣺
��1��д������������X________��Y________(�ѧʽ)��
��2��������CuCl���岻��ˮ������ˮ�Ҵ�ϴ�ӵ�Ŀ����________________________�����������е�����Һ��pH���ܹ����ԭ����________________________��
��3��д������CuCl�Ļ�ѧ����ʽ��__________________________________��
��4����CuCl�����ɹ����������ϲ���Ҫ����SO2���壬��������_________________��
��5����֪��������Ksp(CuCl)=1.6��10-7��Ksp(CuI)=1.2��10-12������CuCl������Һ�м���NaI������c(I-)=0.1mol/L����ʱ��Һ��c(Cu+)/c(Cl-)=________��
��6���Ȼ���ͭ�Ķ�������
�ٳ�ȡ��Ʒ0.25 g�����ѷ���10 mL������FeCl3��Һ����ƿ�У�����ҡ����
�ڴ���Ʒ�ܽ��ˮ50 mL���ڷ�����ָʾ��2�Ρ�
��������0.10 mol��L��1���������Һ�ζ����յ㣬ͬʱ���հ�ʵ��һ�Ρ�
��֪��
CuCl��FeCl3===CuCl2��FeCl2��Fe2����Ce4��===Fe3����Ce3����
������ظ�2�β�ã�
1 | 2 | 3 | |
�հ�ʵ������������ ����Һ�����/mL | 0.75 | 0.50 | 0.80 |
0.25 g��Ʒ���������� ����Һ�����/mL | 24.65 | 25.75 | 24.90 |
�����ݴ����������CuCl�Ĵ���Ϊ_________(ƽ��ʵ�������ܳ���0.3%)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������һ��Ӧ�ù㷺�Ľ���,��ҵ����Al2O3�ͱ���ʯ(Na3AlF6)������ڵ���Ƶá�
�����������Ҫ�ɷ���Al2O3��SiO2�ȡ���������������Al2O3����������:
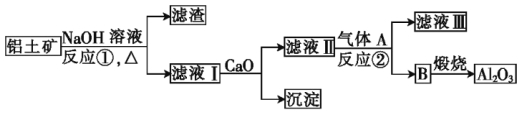
����өʯ(CaF2)�ʹ���Ϊԭ���Ʊ�����ʯ����������:
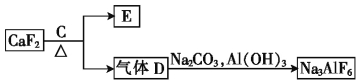
��ش���������:
(1)д����Ӧ�ٵĻ�ѧ����ʽ: ��
(2)��Һ���м���CaO���ɵij����� (�ѧʽ),��Ӧ�ڵ����ӷ���ʽΪ ��
(3)д��������D�Ʊ�����ʯ�Ļ�ѧ����ʽ: ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com