
【题目】“生物质能”主要是指树木、庄稼、草类等植物直接或间接提供的能量,下列说法不正确的是
A. 生物质能是可储存和可运输的非可再生能源 B. 生物质能和化石燃料一样属于一次能源
C. 生物质能是解决农村能源的主要途径 D. 利用生物质能就是间接利用太阳能
 同步练习强化拓展系列答案
同步练习强化拓展系列答案科目:高中化学 来源: 题型:
【题目】X、Y、Z、R、W为五种短周期元素。X原子最外层电子数是核外电子层数的3倍;Y最高正价与最低负价代数和为4;Z的单质常用于漂白工业;R是短周期元素中金属性最强的元素,W是生活中的常见金属,其氧化物常做耐高温材料。回答下列问题:
(1)Y元素的名称______,在周期表中的位于第三周期__________族
(2)W与Z单质化合得到的物质属于__________化合物(选填“离子”或“共价”),向其溶液中加入足量NaOH溶液,反应的离子方程式为______。
(3)工业上常用W单质与氨气在1700℃发生置换反应,生成一种最轻的气体和一种坚硬耐磨的固体,试写出该反应的化学方程式_________________________。
(4)化合物甲由元素X、R组成,甲能与水剧烈反应,并产生大量气泡,写出其化学反应方程式______,甲的电子式为_____________。
(5)为比较元素X和Y的非金属性强弱,下列方法不可行的是___。
a.比较这两种元素的常见单质的沸点
b.比较这两种元素的单质与氢气化合的难易
c.比较这两种元素的气态氢化物的稳定性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制取氯气的化学方程式为:MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O。请分别用双线桥法和单线桥法分析该反应中电子转移的方向和数目:
MnCl2+Cl2↑+2H2O。请分别用双线桥法和单线桥法分析该反应中电子转移的方向和数目:
双线桥:MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O。
MnCl2+Cl2↑+2H2O。
__________________________________________
单线桥:MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O。
MnCl2+Cl2↑+2H2O。
___________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新鲜水果、蔬菜、乳制品中富含的维生素C具有明显的抗衰老作用,但易被空气氧化。某课外小组利用碘滴定法测某橙汁中维生素C的含量,其化学方程式为

下列说法正确的是( )
A. 上述反应为取代反应 B. 脱氢维生素C的分子式为C6H5O6
C. 滴定时应剧烈振荡锥形瓶 D. 滴定时可用淀粉溶液作指示剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】己知1mol 链烃CxHy可以发生如下系列转化:CxHy![]() Q
Q![]() CxCl12(无机试剂是足量的)下列说法错误的是
CxCl12(无机试剂是足量的)下列说法错误的是
A. x=5、n=11
B. 用酸性高锰酸钾溶液可以区分CxHy和Q
C. 上述转化过程中依次发生了加成反应和取代反应
D. CxCl12可能的结构有三种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物X(分子式为C4H6O5)广泛存在于许多水果中,尤以苹果、葡萄、西瓜、山楂内为多。经测定该有机物具有下列性质(见下表)。请根据题目要求填空:
X的性质 | |
① | X与足量的金属钠反应产生氢气 |
② | X与醇或羧酸在浓硫酸加热条件下均能生成有香味的产物 |
③ | 在一定条件下X的分子内脱水产物(不是环状化合物)可与溴水发生加成反应 |
④ | 33.5gX与100mL的5mol/LNaOH溶液恰好完全中和 |
(1)X的可能结构简式I:________,Ⅱ:__________,Ⅲ:__________。
(2)在一定条件下有机物X可发生化学反应的类型有(填序号)__________。
A.水解反应 B.取代反应 C.加成反应 D.消去反应 E.加聚反应 F.中和反应
(3)下列物质与X互为同系物的是(填序号)_______,与X互为同分异构体的是(填序号)_______。
(a)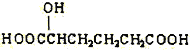 (b)
(b)![]()
(c)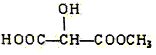 (d)H3COOC-COOCH3
(d)H3COOC-COOCH3
(e)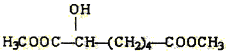 (f)
(f)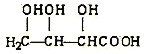
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、R、M、N为六种短周期元素,其原子半径和最外层电子数之间的关系如图所示。
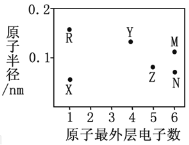
(1)M元素的原子核外有__________种能量不同的电子,有__________个未成对电子;Z元素在元素周期表中的位置是第______周期________族。
(2)N、R、X三种元素的原子可构成一种强碱性物质,该物质的电子式是___________;Y元素的氧化物是制造光纤的主要材料,该氧化物是________晶体(填晶体类型)。某化工生产的核心环节的反应为:2MN2(g) + N2(g) 2 MN3(g) + Q(Q>0)
(3)该反应的平衡常数表达式![]() __________________________;欲使K值变大,可采取的措施是__________________________。
__________________________;欲使K值变大,可采取的措施是__________________________。
(4)该反应达到平衡后,在其他条件不变的情况下,若使得容器的体积扩大为原来的两倍,则平衡____________________。(选填“正向移动”、“逆向移动”或“不移动”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组通过查阅资料得知,CO2与Na2O2的反应需要在一定量水蒸气存在的条件下才能进行,于是他们设计了如图所示的装置对此问题进行探究,同时验证Na2O2与CO2反应的气体产物。

(1)写出装置A中有关反应的离子方程式:_________________,装置B中的试剂是____,装置E的作用是_____________。
(2)U形管C中的试剂是____。若要求根据装置D中的现象来确定CO2与Na2O2之间的反应是否需要在潮湿的条件下才能进行,对两个止水夹的操作方式为先打开K1,关闭K2,D中无明显现象;当打开K2,关闭K1,D中的现象为 ______________,则说明反应需要在潮湿条件下进行。
(3)检验气体产物的方法:用玻璃片在水里盖住集气瓶口,将集气瓶从水中取出,正放在实验台上,_______________。
(4)有人认为,经过较长时间反应后,装置D中生成的物质只有Na2CO3而没有NaOH。请设计一个方案证明此结论是正确的:______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com