
【题目】一种3D打印机的柔性电池以碳纳米管作电极材料,以吸收ZnSO4溶液的有机高聚物为固态电解质,其电池总反应为:
![]() ,其电池结构如图1所示,图2是有机高聚物的结构片段。下列说法不正确的是
,其电池结构如图1所示,图2是有机高聚物的结构片段。下列说法不正确的是
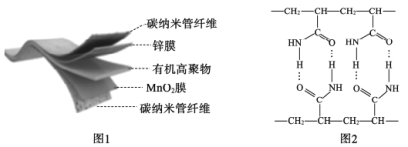
A.放电时,含有锌膜的碳纳米管纤维作电池负极
B.有机高聚物中含有的化学键有:极性键、非极性键和氢键
C.合成有机高聚物的单体是![]()
D.放电时,电极的正极反应为:MnO2+e-+H2O=MnOOH+OH-
【答案】B
【解析】
电池放电时是原电池由总的电极反应可知,含有锌膜的碳纳米管纤维作电池负极,二氧化锰做正极,负极失电子发生氧化反应,Zn-2e-=Zn2+,正极为MnO2+e-+H2O=MnOOH+OH-,根据高聚物的分子结构进行判断。
A.根据分析可知,放电时,含有锌膜的碳纳米管纤维作电池负极,失电子发生氧化反应,故A正确;
B.根据图中信息,有机高聚物中含有的化学键有:碳氧、碳氮、氮氢等原子形成的极性键、碳碳原子之间形成的非极性键,氮氧原子形成的氢键属于分子间作用力,不属于化学键,故B错误;
C.图中可以看出合成有机高聚物的单体是![]() ,故C正确;
,故C正确;
D.放电时,二氧化锰做正极,化合价降低,转变为MnOOH,电极的正极反应为:MnO2+e-+H2O=MnOOH+OH-,故D正确;
答案选B。


 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案科目:高中化学 来源: 题型:
【题目】在密闭容器中,将1.0mol CO与1.0mol H2O混合加热到800℃,发生下列反应:CO(g)+H2O(g)![]() CO2(g)+H2(g)。一段时间后该反应达到平衡,测得CO的物质的量为0.5mol.则下列说法正确的是( )
CO2(g)+H2(g)。一段时间后该反应达到平衡,测得CO的物质的量为0.5mol.则下列说法正确的是( )
A.800℃下,该反应的化学平衡常数为0.25
B.427℃时该反应的平衡常数为9.4,则该反应的△H<0
C.800℃下,若继续向该平衡体系中通入1.0mol的CO(g),则平衡时CO物质的量分数为33.3%
D.800℃下,若继续向该平衡体系中通入1.0mol的H2O(g),则平衡时CO转化率为33.3%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学为测定一定质量的钠与水反应产生的氢气的体积,设计了图装置进行实验。
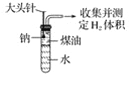
(1)实验开始,欲使钠与水接触反应,应如何操作?______________________________;反应开始后,试管中能观察到的现象是__________________________________________。
(2)已知有关物质的密度ρ(K):0.86 g·cm-3,ρ(Na):0.97 g·cm-3,ρ(煤油):0.8 g·cm-3。如果将钠换成相同大小的钾进行上述实验,结果钾反应完所用时间比钠反应完所用的时间________(填“长”或“短”),其原因是________________________________。
(3)从实验的安全考虑,比较金属钠、钾与水反应的实验操作图A、图B,请指出图B表示哪种金属与水反应____________________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钢铁制品经常进行烤蓝处理,主要目的是在表面生成一层致密的Fe3O4。为了研究烤蓝铁片,把一定量烤蓝铁片加工成均匀粉末,取mg该粉末,放入28.00 mL 1.000mol·L-1的盐酸中,恰好完全反应,生成134.4 mL气体(标准状况)。向反应后的溶液中滴入KSCN溶液,无明显现象。
(1)计算mg样品中n(Fe3O4)=______mol。
(2)写出具体计算过程∶_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验方案中,能达到相应实验目的的是
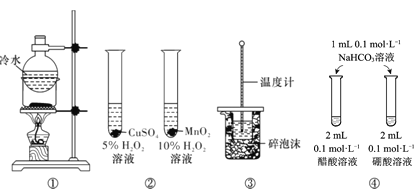
A.方案①用于分离I2和NH4Cl固体
B.方案用于比较CuSO4和MnO2的催化活性
C.方案③用于测定中和热
D.方案④用于比较醋酸和硼酸的酸性强弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下的定容容器中,当下列哪些物理量不再发生变化时,表明反应A(g)+2B(g) ![]() C(g)+D(g),已达到平衡状态的是( )
C(g)+D(g),已达到平衡状态的是( )
①混合气体的压强 ②混合气体的密度 ③B的物质的量浓度
④混合气体的总物质的量 ⑤混合气体的平均相对分子质量 ⑥v(C)与v(D)的比值 ⑦混合气体的总质量 ⑧混合气体的总体积 ⑨C、D的分子数之比为1∶1
A. ①②③④⑤⑥⑦⑧B. ①③④⑤
C. ①②③④⑤⑦D. ①③④⑤⑧⑨
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢气是未来最理想的能源,科学家最近研制出利用太阳能产生激光,并在二氧化钛(TiO2)表面作用使海水分解得到氢气的新技术:2H2O![]() 2H2↑+O2↑。制得的氢气可用于燃料电池。试回答下列问题:
2H2↑+O2↑。制得的氢气可用于燃料电池。试回答下列问题:
(1)分解海水时,________能转变为________能,二氧化钛作________。生成的氢气用于燃料电池时,________能转变为________能。水分解时,断裂的化学键为________键,分解海水的反应属于________反应(填“放热”或“吸热”)。
(2)某种氢氧燃料电池是用固体金属氧化物陶瓷作电解质,两极上发生的电极反应如下:
A极:2H2+2O2--4e-=2H2O
B极:O2+4e-=2O2-
则A极是电池的________极;电子从该极________(填“流入”或“流出”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表中的A、B、C、D表示元素周期表中的四个区域:
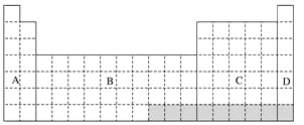
(1)全部是金属元素的区域为____________。
(2)短周期甲元素的单质在冷的浓硫酸或空气中,表面都生成致密的氧化膜,甲的原子序数是________。
(3)短周期乙元素的原子核外第三层电子数与第一层电子数相等,则乙元素位于元素周期表的第_______周期第______族。
(4)用元素符号将甲、乙两元素填写在上面元素周期表中对应的位置________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)家用液化气的主要成分之一是丁烷(C4H10),当1kg丁烷完全燃烧生成二氧化碳和液态水时,放出热量为5×104kJ,试写出表示丁烷燃烧热的热化学方程式___。
(2)科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇,并开发出直接以甲醇为燃料的燃料电池。已知H2(g)、CO(g)和CH3OH(l)的燃烧热ΔH分别为-285.8kJ/mol、-283.0kJ/mol和-726.5kJ/mol。请回答下列问题:
①用太阳能分解10mol水消耗的能量是___kJ;
②甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式_____;
③研究NO2、SO2、CO等大气污染气体的处理具有重要意义,已知:
2SO2(g)+O2(g)=2SO3(g) ΔH=-196.6 kJ/mol
2NO(g)+O2(g)=2NO2(g) ΔH=-113.0kJ/mol
则反应NO2(g)+SO2(g)=SO3(g)+NO(g)的ΔH=___kJ/mol。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com