
 赢在课堂名师课时计划系列答案
赢在课堂名师课时计划系列答案 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案科目:高中化学 来源:2015-2016学年江苏省华士、成化、山观三校高二上期中选修化学试卷(解析版) 题型:填空题
按下列要求填空
(1)右面六组物质:(填序号)

属于同系物的是_______________________
属于同分异构体是_____________________
属于同种物质的是_____________________
(2)按要求完成下列问题:
①某高分子有机物 是由一种单体脱水缩聚而成的,该单体的键线式为____________
是由一种单体脱水缩聚而成的,该单体的键线式为____________
②将少量水杨酸(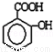 )滴入Na2CO3溶液中,生成的有机物的结构简式是:____________
)滴入Na2CO3溶液中,生成的有机物的结构简式是:____________
③CH2ClCOOCH2CH3与NaOH的水溶液共热的方程式:__________________
④有机物 在较高温度下和Br2按物质的量之比1:1发生1,4-加成反应的化学方程式
在较高温度下和Br2按物质的量之比1:1发生1,4-加成反应的化学方程式
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江西八一、洪都、麻丘中学等高一上期中联考化学试卷(解析版) 题型:选择题
下列溶液中,Cl-的物质的量浓度最大的是
A.100 mL 0.5 mol/L AlCl3(aq)
B.200 mL 0.5 mol/L MgCl2(aq)
C.400 mL 0.7 mol/L BaCl2(aq)
D.300 mL 1 mol/L NaCl(aq)
查看答案和解析>>
科目:高中化学 来源:2015-2016学年浙江省高一上10月月考化学试卷(解析版) 题型:选择题
以下是对某水溶液进行离子检验的方法和结论,其中正确的是
A.先加入BaCl2溶液,再加入足量的HNO3溶液,产生了白色沉淀。溶液中一定含有大量的SO42-
B.加入足量的CaCl2溶液,产生了白色沉淀。溶液中一定含有大量的CO32-
C.加入足量浓 NaOH溶液,产生了带有强烈刺激性气味的气体,该气体可以使湿润的红色石蕊试纸变蓝,则溶液中一定含有大量的NH4+
D.先加适量的盐酸将溶液酸化,再加AgNO3溶液,产生了白色沉淀。溶液中一定含有大量的Cl-
查看答案和解析>>
科目:高中化学 来源:2015-2016学年浙江省高一上10月月考化学试卷(解析版) 题型:选择题
下列物质在水中的电离方程式书写正确的是
A.NaHSO4=Na++HSO4-
B.NaHCO3=Na++H++CO32-
C.KClO3=K++Cl-+3O2-
D.Al2(SO4)3=2Al3++3SO42-
查看答案和解析>>
科目:高中化学 来源:2015-2016学年安徽省宣城、郎溪、广德三校高二上期中联考化学试卷(解析版) 题型:实验题
滴定实验是中学常用的定量实验,主要原理是利用已知浓度的某溶液滴加到未知浓度的溶液中,通过恰好完全反应的“终点”的判断,实验测出消耗的两种物质的量来计算未知浓度的溶液的浓度。
下面是甲同学用滴定实验来测定食用精制盐中的碘含量(食盐中加入一定量的KIO3)。
已知:I2+2S2O32-=2 I-+S4O62-,其步骤为:
A.准确称取w g食盐,加适量蒸馏水使其完全溶解;
B.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全;
C.以淀粉为指示剂,逐滴加入物质的量浓度为2.000×10-3 mol/L的Na2S2O3溶液15.00 mL,恰好反应完全。
(1)配平化学方程式 KIO3+ KI+ H2SO4= K2SO4+ I2+ H2O
(2)判断c中反应恰好完全依据的现象是:当滴加最后一滴Na2S2O3溶液后,溶液由 色变为 色,且颜色半分钟内不改变 。
(3)根据以上实验,所测精制食盐中的碘含量是 mg/kg。(以含w的代数式表示)
(4)已知在酸性环境下:2H+ + S2O32- = S↓ + SO2 ↑+ H2O,所以乙同学认为在c操作前应 ,否则实验测得食盐中碘的含量会 (填“偏高”或“偏低”或“没有影响”)
查看答案和解析>>
科目:高中化学 来源:2015-2016学年安徽省宣城、郎溪、广德三校高二上期中联考化学试卷(解析版) 题型:选择题
下列关于反应N2 + 3H2 2NH3的反应速率说法一定正确的是
2NH3的反应速率说法一定正确的是
A.每消耗1molN2的同时消耗2molNH3
B.相同时间内消耗28gN2与消耗6gH2的反应速率相同
C.当 (N2)=3
(N2)=3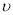 (H2)时表示反应已达平衡
(H2)时表示反应已达平衡
D.2min内H2减少3mol,则 (N2)=0.5mol/(L·min)
(N2)=0.5mol/(L·min)
查看答案和解析>>
科目:高中化学 来源:2015-2016学年陕西省高二上学期期中测试化学试卷(解析版) 题型:填空题
已知水在25℃和95℃时,其电离平衡曲线如下图所示:
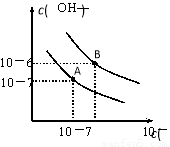
(1)则95℃时水的电离平衡曲线应为 (填“A”或“B”)。
(2)25℃时,将pH=9的NaOH溶液与pH=4的H2SO4溶液混合,所得溶液的pH=7,则NaOH溶液与H2SO4溶液的体积比为
(3)95℃时,若1体积pH1=a的某强酸溶液与1体积pH2=b的某强碱溶液混合后溶液呈中性,则混合前,该强酸的pH1与强碱的pH2之间应满足的关系是(用含a、b的等式表示):
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖北省高二上学期期中测试化学试卷(解析版) 题型:选择题
对于可逆反应:mA(g)+nB(g)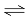 xC(g)+ yD(s) ΔH=?,在不同温度及压强(P1,P2)条件下,反应物A的转化率如下图所示,下列判断正确的是
xC(g)+ yD(s) ΔH=?,在不同温度及压强(P1,P2)条件下,反应物A的转化率如下图所示,下列判断正确的是

A.ΔH>0,m+n>x+y B.ΔH<0,m+n>x+y
C.ΔH<0,m+n>x D.ΔH>0,m+n<x
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com