
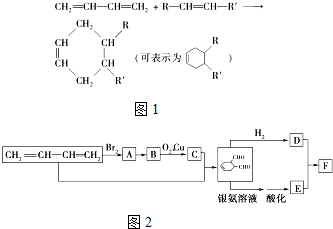
 中含氧官能团的名称是醛基
中含氧官能团的名称是醛基 OHCCH=CHCHO+2H2O.
OHCCH=CHCHO+2H2O. .
. 、HC≡CCOOCH3.
、HC≡CCOOCH3. 分析 根据流程图和所给信息,A为1,3-丁二烯和溴单质加成的产物,即A为CH2BrCH=CHCH2Br,B到C的转化醇被氧化为醛的反应,故B为CH2OHCH=CHCH2OH,C为OHCCH=CHCHO,据题目所给的信息反应转化后可推知E为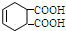 ,D为
,D为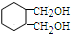 ,F为
,F为 ,
,
(1)根据官能团的名称来回答;
(2)根据A到B的反应情况来确定所需要的试剂;
(3)根据伯醇能被氧气氧化为醛的化学性质来回答;
(4)根据物质之间的转化条件和性质来分析;
(5)根据同分异构题的书写方法来回答.
解答 解:(1)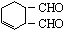 中含氧官能团是醛基,故答案为:醛基;
中含氧官能团是醛基,故答案为:醛基;
(2)从A到B的转化过程是将卤代烃转化为醇类,条件为:NaOH的水溶液;CH2=CH-CH=CH2与溴反应生成CH2BrCH=CHCH2Br,属于加成反应;CH2=CH-CH=CH2和OHCCH=CHCHO生成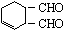 属于加成反应;
属于加成反应;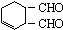 与H2反应生成
与H2反应生成 属于加成反应,共有3个加成反应,故答案为:NaOH的水溶液;3;
属于加成反应,共有3个加成反应,故答案为:NaOH的水溶液;3;
(3)B为CH2OHCH=CHCH2OH与O2反应的方程式为:CH2OHCH=CHCH2OH+O2 OHCCH=CHCHO+2H2O;故答案为:
OHCCH=CHCHO+2H2O;故答案为:
CH2OHCH=CHCH2OH+O2 OHCCH=CHCHO+2H2O;
OHCCH=CHCHO+2H2O;
(4)F是 和
和 之间发生酯化反应后的产物,结构简式为:
之间发生酯化反应后的产物,结构简式为: ,故答案为:
,故答案为: ;
;
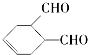
(5)C为OHCCH=CHCHO,符合条件的同分异构体有: HC≡CCOOCH3,故答案为:
HC≡CCOOCH3,故答案为: 、HC≡CCOOCH3.
、HC≡CCOOCH3.
点评 本题是一道有机框图推断题,考查了有机物的化学性质、官能团名称和有关化学反应类型的知识,难度较大.


 一本好题口算题卡系列答案
一本好题口算题卡系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 通常状况下,NA 个CO2分子占有的体积为22.4L | |
| B. | 常温常压下,1.06g Na2CO3含有的Na+离子数为0.02 NA | |
| C. | 标准状况下,22.4LH2O含有的分子数为 NA | |
| D. | 物质的量浓度为0.5 mol/L的MgCl2溶液中,含有Cl-个数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氮化硅陶瓷 耐高温 | B. | 氧化锆陶瓷 韧性和耐磨性 | ||
| C. | 钛酸钡陶瓷 导电性 | D. | 氧化铝陶瓷 透光性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 糖类和蛋白质都是人体重要的营养物质 | |
| B. | 蛋白质在一定条件下能发生水解反应,生成氨基酸 | |
| C. | 加热能杀死甲型H1N1流感病毒,因为病毒的蛋白质受热变性 | |
| D. | 蛋白质溶液中加入饱和硫酸铵溶液,蛋白质析出,如再加水也不溶解 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ⑥③②④①⑤ | B. | ⑤④③①②⑥ | C. | ⑥③①②④⑤ | D. | ②③①④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com