
(8分)(1)2 mol O3和3 mol O2的质量之比________,体积之比________.
(2)若12.4 g Na2X中含有0.4 mol钠离子,Na2X的摩尔质量是________ X的相对原子质量是________.
科目:高中化学 来源: 题型:阅读理解
| A | |||||||||||||||||
| B | C | D | E | F | |||||||||||||
| G | H | I | J | ||||||||||||||
| K | M | L |





查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| SO | 2- 3 |
| ||
| (540.0×10-10cm)3 |
| ||
| (540.0×10-10cm)3 |
| 270.0 | ||
|
135.0×
| ||
sin
|
| 3 |
| 270.0 | ||
|
135.0×
| ||
sin
|
| 3 |
查看答案和解析>>
科目:高中化学 来源:2015届江西省四校高一零班第一次月考化学试卷(解析版) 题型:计算题
(10分)(1)12.4 g Na2X含有0.4 mol Na+,Na2X的摩尔质量为_____,其相对分子质量为______,X的相对原子质量为________,该物质的化学式为________。
(2)相同状况下,一定体积的气态氢化物HmX的质量是等体积NH3的2倍。则X的相对原子质量为________。(用含m的代数式表示)
(3)a个X原子的总质量为b g,则X的相对原子质量可表示为________。
(4)20 g A物质和14 g B物质完全反应,生成8.8 g C物质、3.6 g D物质和0.2 mol E物质,则E物质的摩尔质量为________。
(5)483 g Na2SO4·10H2O中所含的Na+的物质的量是 mol,SO42—的物质的量是 mol,所含O原子的数目是 个。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年重庆市高三上学期期中考试理科综合试题(化学部分) 题型:实验题
(18分)测定SO2转化成SO3的转化率可以用下图装置,装置中烧瓶内发生的化学反应方程式为:Na2SO3(s)+H2SO4(85%)=Na2SO4+H2O+SO2↑。
(已知SO3的熔点是16.8℃,沸点是44.8℃)
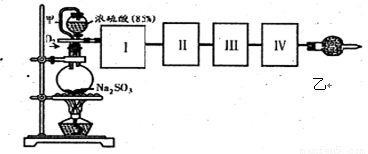
(1)装置中甲管的作用是 ;
乙装置的作用是 。
(2)根据实验需要,应该在I、II、Ⅲ、IV处连接合适的装置,请从下图A~E装置中选择最适合装置并将其序号填放下面的空格中。I、Ⅱ、Ⅲ、Ⅳ处连接的装置分别是 、 、 、 。
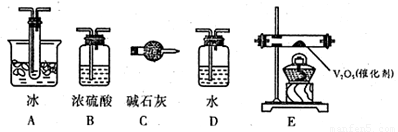
(3)为使SO2有较高的转化率,实验中加热催化剂与滴加浓硫酸的顺序中,应采取的操作是 ,若用大火加热烧瓶时,SO2的转化率会 (填“升高”、“不变”或“降低”)。
(4)将SO2通入含1 mol氯酸的溶液中,可生成一种强酸和一种氧化物,并有6.02×1023个电子转移,则该反应的化学方程式为 。
(5)用nmolNa2SO3粉末与足量浓硫酸进行此实验,当反应结束时,继续通入O2一段时间后,测得装置Ⅳ增重了mg,则实验中SO2的转化率为 。(用含m、n的代数式填写)
查看答案和解析>>
科目:高中化学 来源:09~10学年三明市五校高二下学期期中联考化学卷 题型:填空题
(8分)(1)短周期某主族元素M的电离能情况如图A所示。则M元素位于周期表的第___族。
|
|
|
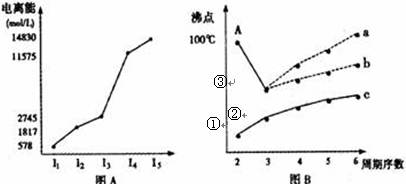 (2)图B是研究部分元素的氢化物的沸点变化规律的图像,折线c可以表达出第 族元素氢化物的沸点的变化规律,①②③中表示为SiH4的是________
(2)图B是研究部分元素的氢化物的沸点变化规律的图像,折线c可以表达出第 族元素氢化物的沸点的变化规律,①②③中表示为SiH4的是________

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com