
| A. | Na2SO4=Na2++SO42- | B. | MgCl2=Mg2++Cl- | ||
| C. | HNO3=H++3NO- | D. | Ba(OH)2=Ba2++2OH- |
分析 A.钠离子带有一个正电荷;
B.电荷不守恒;
C.硝酸根离子符号错误;
D.Ba(OH)2是强电解质完全电离出钡离子和氢氧根离子.
解答 解:A.钠离子带有一个正电荷,则其电离方程式为:Na2SO4=2Na++SO42-,故A错误;
B.氯化镁在溶液中电离出一个镁离子和两个氯离子,则电离方程式为:MgCl2=Mg2++2Cl-,故B错误;
C.硝酸根离子符号错误,电离方程式为:HNO3=H++NO3-,故C错误;
D.Ba(OH)2是强电解质完全电离出钡离子和氢氧根离子,则电离方程式为:Ba(OH)2=Ba2++2OH-,故D正确.
故选D.
点评 本题考查电离方程式的书写知识,注意强电解质在溶液中能完全电离,弱电解质部分电离,离子团在电离方程式中不能拆开,强酸的酸式根离子要拆开,弱酸的酸式根离子不能拆开,题目难度不大.


科目:高中化学 来源: 题型:解答题
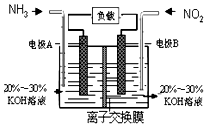 空气质量与我们的健康息息相关,目我国通过检测6项污染物的质量浓度来计算空气质量指数(AQI),SO2、NO2、和CO是其中3项中的污染物.
空气质量与我们的健康息息相关,目我国通过检测6项污染物的质量浓度来计算空气质量指数(AQI),SO2、NO2、和CO是其中3项中的污染物.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
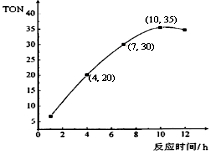 甲醇和CO2可直接合成DMC:2CH3OH(g)+CO2 (g)?CH3OCOOCH3 (g)+H2O(g),但甲醇转化率通常不会超过1%,制约该反应走向工业化生产.
甲醇和CO2可直接合成DMC:2CH3OH(g)+CO2 (g)?CH3OCOOCH3 (g)+H2O(g),但甲醇转化率通常不会超过1%,制约该反应走向工业化生产.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
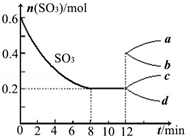 在一个2L的密闭容器中投入反应物,发生反应2SO3(g)?2SO2(g)+O2(g)△H>0,其中SO3的变化如图所示:
在一个2L的密闭容器中投入反应物,发生反应2SO3(g)?2SO2(g)+O2(g)△H>0,其中SO3的变化如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “胃得乐”(主要成分为碳酸镁)是一种抗酸药) | |
| B. | 鸦片、吗啡、海洛因等这些物质属于毒品 | |
| C. | 青霉素能抑制细菌细胞壁的生长,致使细菌因细胞破裂而死亡 | |
| D. | “阿司匹林”是一种重要的抗生素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定条件下水由气态变为液态 | |
| B. | 高温高压条件下使石墨转化为金刚石 | |
| C. | 有序排列的火柴散落 | |
| D. | CO点燃时生成CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 任何温度下反应均难以自发进行 | B. | 任何温度下反应均可以自发进行 | ||
| C. | 仅常温下反应可以自发进行 | D. | 仅高温下反应可以自发进行 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
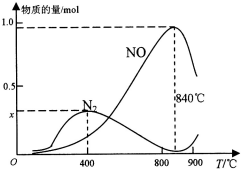 氨催化氧化是硝酸工业的基础,按要求回答下列问题:
氨催化氧化是硝酸工业的基础,按要求回答下列问题:| 化学键 | N-H |  | O-H | O=O |
| E/(kJ•mol-1) | x | y | m | n |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com