
已知某“84消毒液”瓶体部分标签如图所示,该“84消毒液”通常稀释100倍(体积之比)后使用。请回答下列问题:

(1)该“84消毒液”的物质的量浓度约为 mol·L-1。
(2)某同学取100 mL该“84消毒液”,稀释后用于消毒,稀释后的溶液中c(Na+)= mol·L-1。
(3)该同学参阅该“84消毒液”的配方,欲用NaClO固体配制480 mL含NaClO质量分数为25%的消毒液。下列说法正确的是 (填序号)。
A.如图所示的仪器中,有三种是不需要的,还需要一种玻璃仪器
B.容量瓶用蒸馏水洗净后,应烘干后才能用于溶液配制
C.配制过程中,未用蒸馏水洗涤烧杯和玻璃棒可能导致结果偏低
D.需要称量NaClO固体的质量为143.0 g

(4)“84消毒液”与稀硫酸混合使用可增强消毒能力,某消毒小组人员用98%(密度为1.84 g·cm-3)的浓硫酸配制2 000 mL 2.3 mol·L-1的稀硫酸用于增强“84消毒液”的消毒能力。
①所配制的稀硫酸中,H+的物质的量浓度为 mol·L-1。
②需用浓硫酸的体积为 mL。
(1)4.0 (2)0.04 (3)C (4)①4.6 ②250
【解析】(1)由c=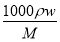 得,c(NaClO)=
得,c(NaClO)=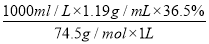 ≈4.0(mol·L-1)。
≈4.0(mol·L-1)。
(2)稀释前后溶液中NaClO的物质的量不变,则有:100 mL×10-3 L·mL-1×4.0 mol·L-1=100 mL×100×10-3 L·mL-1×c(NaClO),解得稀释后c(NaClO)=0.04 mol·L-1,c(Na+)=c(NaClO)=0.04 mol·L-1。(3)选项A,需用托盘天平称量NaClO固体,需用烧杯来溶解NaClO,需用玻璃棒进行搅拌和引流,需用容量瓶和胶头滴管来定容,图示的A、B不需要,但还需玻璃棒和胶头滴管。选项B,配制过程中需要加入水,所以经洗涤干净的容量瓶不必烘干后再使用。选项C,未洗涤烧杯和玻璃棒将导致配制的溶液中溶质的物质的量减小,结果偏低。选项D,应选取500 mL的容量瓶进行配制,然后取出480 mL即可,所以需要NaClO的质量:0.5 L×4.0 mol·L-1×74.5 g·mol-1=149.0 g。(4)①根据H2SO4的组成可知,溶液中c(H+)=2c(H2SO4)=4.6 mol·L-1。②2 000 mL 2.3 mol·L-1的稀硫酸中溶质的物质的量为2 L×2.3 mol·L-1=4.6 mol,设需要98%(密度为1.84 g·cm-3)的浓硫酸的体积为V mL,则有: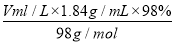 =4.6 mol,解得V=250。
=4.6 mol,解得V=250。


科目:高中化学 来源:2014年高考化学苏教版总复习 1-1 物质的分类、转化及分散系练习卷(解析版) 题型:选择题
已知甲、乙、丙、X是4种中学化学中常见的物质,其转化关系如图所示。则甲和X不可能是 ( )
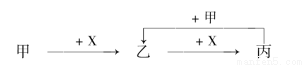
A.甲C,X为O2
B.甲为SO2,X为NaOH溶液
C.甲为Fe,X为Cl2
D.甲为AlCl3溶液,X为NaOH溶液
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版一轮复习2-3-1氧化还原反应概念和规律练习卷(解析版) 题型:选择题
反应①是自海藻灰中提取碘的主要反应,反应②是自智利硝石中提取碘的主要反应:①2NaI+MnO2+3H2SO4=2NaHSO4+MnSO4+2H2O+I2、②2NaIO3+5NaHSO3=2Na2SO4+3NaHSO4+H2O+I2。已知NaIO3的氧化性与MnO2相近,下列有关说法正确的是 ( )。
A.I2在反应①中是还原产物,在反应②中是氧化产物
B.两个反应中生成等量的I2时转移的电子数相等
C.NaI和NaIO3在一定条件下能反应生成I2
D.NaIO3在化学反应中只能作氧化剂不能作还原剂
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版一轮复习2-2电解质 离子反应练习卷(解析版) 题型:选择题
下列说法中正确的是 ( )。
A.氯化钠在电流的作用下电离出Na+和Cl-
B.CaCO3难溶于水,但CaCO3属于强电解质
C.二氧化碳溶于水能部分电离,故二氧化碳属于弱电解质
D.硫酸钠在水中的电离方程式可表示为Na2SO4=2Na++S6++4O2-
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版一轮复习2-1物质的分类与转化 分散系练习卷(解析版) 题型:选择题
Fe(OH)3胶体虽然是由FeCl3溶液制得,但两者是截然不同的两种物质。FeCl3溶液、Fe(OH)3胶体共同具备的性质是 ( )。
A.都呈透明的红褐色
B.分散质颗粒直径相同
C.都比较稳定,密封保存一段时间都不会产生沉淀
D.当有光线透过时,都能产生丁达尔效应
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版一轮复习1-2-2溶液的配制及误差分析练习卷(解析版) 题型:选择题
在溶液的配制过程中会引起浓度偏高的是 ( )。
①用1 g 98%的浓硫酸加4 g水配制成19.6%的硫酸
②配制一定物质的量浓度的硫酸溶液时,定容后,塞好塞子倒转摇匀后,发现液面低于刻度线
③10%的硫酸和90%的硫酸等体积混合配制50%的硫酸溶液
④向80 mL水中加入18.4 mol·L-1硫酸20 mL,配制3.68 mol·L-1的硫酸溶液
⑤质量分数为5x%和x%的两种氨水等体积混合配制成3x%的氨水
A.①③⑤ B.②④⑤ C.③④ D.④⑤
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版一轮复习1-2-1物质的量 气体摩尔体积练习卷(解析版) 题型:实验题
测定1 mol氧气在标准状况下所占体积的实验操作的步骤如下:
①按下图装配实验装置。
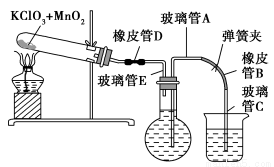
②洗净试管然后充分干燥。
③向500 mL烧瓶里装满水,向500 mL烧杯里加入少量水,把连接烧瓶和烧杯的玻璃管A、橡皮管B和玻璃管C中也装满水,在中间不要留下气泡,然后用弹簧夹把橡皮管B夹紧。
④称得试管的质量为14.45 g,往试管里加入KClO3和MnO2的混合物,再称其质量为15.95 g。
⑤打开弹簧夹,把烧杯举起使烧瓶和烧杯中的水面一致,再关闭弹簧夹,然后把烧杯中的水倒掉。
⑥打开弹簧夹,加热试管的混合物到不再产生气体,即水不再流向烧杯时为止。
⑦反应完毕后把装置冷却到室温。
⑧调节烧杯的高度使烧瓶和烧杯中的水面一致,然后再关闭弹簧夹。
⑨用500 mL量筒测量烧杯里水的体积为285.0 mL,把它换算为标准状况下氧气的体积为279.7 mL。
⑩再称量冷却后试管的质量为15.55 g。
(1)在操作⑦中,装置冷却时,玻璃管C的出口一直要在烧杯的水中,不能离开水面,其理由是 。
(2)简述操作⑧的必要性,即为什么要调节烧杯的高度,使烧瓶和烧杯中的水面一致? 。
(3)标准状况下,1 mol氧气所占的体积(保留小数后两位)为 L;混合物中MnO2的质量分数为 。
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版一轮复习1-1-2物质的分离和提纯练习卷(解析版) 题型:选择题
提纯含有少量硝酸钡杂质的硝酸钾溶液,可以使用的方法为 ( )。
A.加入过量碳酸钠溶液,过滤,除去沉淀,溶液中补加适量硝酸
B.加入过量硫酸钾溶液,过滤,除去沉淀,溶液中补加适量硝酸
C.加入过量硫酸钠溶液,过滤,除去沉淀,溶液中补加适量硝酸
D.加入过量碳酸钾溶液,过滤,除去沉淀,溶液中补加适量硝酸
查看答案和解析>>
科目:高中化学 来源:2014年高考化学考前题型专练 保温训练(一)(解析版) 题型:填空题
(14分)锆产业是极有发展潜力及前景的新兴产业,锆(Zr)元素是核反应堆燃料棒的包裹材料,二氧化锆(ZrO2)可以制造耐高温纳米陶瓷。我国有丰富的锆英石(ZrSiO4),含Al2O3、SiO2、Fe2O3等杂质,生产锆流程之一如下:
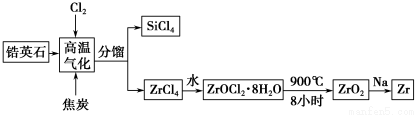
试回答下列问题:
(1)写出上述流程中高温气化的反应方程式(碳转化成CO):_______________________________________________。
(2)写出ZrOCl2·8H2O在900 ℃生成ZrO2的反应方程式: ______________ ______________________________________________。
(3)关于二氧化锆纳米陶瓷和锆合金的说法不正确的是________(单选)。
A.二氧化锆纳米陶瓷是新型无机非金属材料
B.1 nm=10-10m
C.锆合金的硬度比纯锆要高
D.日本福岛核电站的爆炸可能是由锆合金在高温下与水蒸气反应产生的氢气
爆炸引起的
(4)一种新型燃料电池,一极通入空气,另一极通入丁烷;电解质是掺杂氧化钇(Y2O3)的二氧化锆(ZrO2)晶体,在熔融状态下能传导O2-。在熔融电解质中,O2-向________(填“正”或“负”)极移动。电池正极电极反应为__________________,负极电极反应为________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com