
【题目】某温度下,体积相同、pH相同的盐酸和氯化铵溶液分别稀释。平衡时的pH随溶液体积变化的曲线如图所示。下列说法正确的是
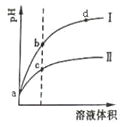
A. 曲线Ⅱ对应氯化铵溶液
B. 与等浓度的NaOH溶液恰好反应时曲线Ⅰ对应的溶液消耗NaOH溶液体积大
C. b点比c点水的电离程度大
D. c、d两点的离子积常数不等
【答案】A
【解析】盐酸是强酸,完全电离。氯化铵溶于水,NH4+水解,溶液显酸性,水解方程式是NH4++H2O![]() NH3·H2O+H+。稀释促进水解,氢离子的物质的量增加,氢离子的浓度还是减小的,但氢离子浓度的变化量要小于盐酸中氢离子浓度的变化量。所以曲线Ⅱ为氯化铵稀释时pH值变化曲线,A项正确;与等浓度的NaOH溶液恰好反应时,氯化铵消耗的多,曲线II对应的溶液消耗NaOH溶液体积大,B项错误;曲线I表示盐酸稀释时pH值变化曲线。盐酸是强酸,抑制水的电离,氯化铵水解促进水的电离,则b点溶液中水的电离程度比c点溶液中水的电离程度小,C项错误;离子积常数属于只与温度有关,D项错误。
NH3·H2O+H+。稀释促进水解,氢离子的物质的量增加,氢离子的浓度还是减小的,但氢离子浓度的变化量要小于盐酸中氢离子浓度的变化量。所以曲线Ⅱ为氯化铵稀释时pH值变化曲线,A项正确;与等浓度的NaOH溶液恰好反应时,氯化铵消耗的多,曲线II对应的溶液消耗NaOH溶液体积大,B项错误;曲线I表示盐酸稀释时pH值变化曲线。盐酸是强酸,抑制水的电离,氯化铵水解促进水的电离,则b点溶液中水的电离程度比c点溶液中水的电离程度小,C项错误;离子积常数属于只与温度有关,D项错误。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】下列实验的现象与对应结论均正确的是
选项 | 操作 | 现象 | 结论 |
A | 将浓硫酸滴到蔗糖表面 | 固体变黑膨胀 | 浓硫酸有脱水性和强氧化性 |
B | 常温下将Al片放入浓硝酸中 | 无明显变化 | Al与浓硝酸不反应 |
C | 向苏打和小苏打溶液中分别加入盐酸 | 均冒气泡 | 两者均能与盐酸反应 |
D | 将水蒸气通过灼热的铁粉 | 粉末变红 | 铁与水在高温下发生反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据表提供的数据,下列判断正确的是
弱酸化学式 | CH3COOH | HClO | H2CO3 |
电离平衡常数 | 1.8×10-6 | 3.0×10-8 | Ka1=4.3×10-7 Ka2=5.6×l0-11 |
A. 等物质的量的Na2CO3和CH3COOH两种溶液混合,一定有:c(Na+)+c(H+)=2c(CO32-)+c(HCO3-)+c(CH3COO-)
B. 常温下,已知酸H2A存在如下平衡:H2A![]() H++HA-;HA-
H++HA-;HA-![]() H++A2-(Ka1=5.9×10-2,Ka2=6.4×10-6),则NaHA溶液中水的电离程度一定大于纯水中水的电离程度
H++A2-(Ka1=5.9×10-2,Ka2=6.4×10-6),则NaHA溶液中水的电离程度一定大于纯水中水的电离程度
C. 相同浓度的CH3COONa和NaClO混合溶液中各离子浓度大小关系是:C(Na+)>c(ClO-)>c(CH3COO-)>c(OH-)>c(H+)
D. 常温下,在0.1mol/LCH3COOH溶液中滴加0.1mol/LNaOH的溶液发生反应,当c(CH3COOH):c(CH3COO-)=5:9时,此时溶液pH=5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】各物质之间的转化关系如下图,部分生成物省略。C、D是由X、Y、Z中两种元素组成的化合物,X、Y、Z的原子序数依次增大,在周期表中X的原子半径最小,Y、Z原子最外层电子数之和为10。D为无色非可燃性气体,G为黄绿色单质气体,J、M为金属,I有漂白作用,反应①常用于制作印刷线路板。

请回答下列问题:
(1)G元素在周期表中的位置______________________,C的电子式______________。
(2)比较Y与Z的原子半径大小:___________________(填写元素符号)。
(3)写出E和乙醛反应的化学反应方程式(有机物用结构简式表示):___________________________;
反应类型:_____。
(4)写出实验室制备G的离子反应方程式:_______________________。
(5)气体D与NaOH溶液反应可生成两种盐P和Q,在P中Na的质量分数为43%,其俗名为____________。
(6)实验室中检验L溶液中的阳离子常选用__________(填化学式)溶液,现象是______________。
(7)A中包含X、Y、Z元素,A的化学式为_____________。
(8)研究表明:气体D在一定条件下可被还原为晶莹透明的晶体N,其结构中原子的排列为正四面体,请写出N及其一种同素异形体的名称_______________________________________、__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化尿素是一种新型漂泊、消毒剂,广泛应用与农业、医药、日用化工等领域。用低浓度的双氧水和饱和尿素溶液在一定条件下可以合成过氧化尿素。反应的方程式为:
CO(NH2)2+H2O2![]() CO(NH2)2·H2O2。过氧化尿素的部分性质如下:
CO(NH2)2·H2O2。过氧化尿素的部分性质如下:
分子式 | 外观 | 热分解温度 | 熔点 | 溶解性 |
CO(NH2)2·H2O2 | 白色晶体 | 45℃ | 75~85℃ | 易溶于水、有机溶剂 |
合成过氧化尿素的流程及反应装置图如图:

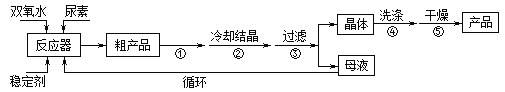
请回答下列问题:
(1)仪器X的名称是__________;冷凝管中冷却水从____(填“a”或“b”)口出来;
(2)该反应的温度控制30℃而不能过高的原因是_______________________。
(3)步骤①宜采用的操作是_____________。
A.加热蒸发 B.常压蒸发 C.减压蒸发
(4)若实验室制得少量该晶体,过滤后需要用冷水洗涤,具体的洗涤操作是_________________。
(5)准确称取1.000g产品于250mL锥形瓶中,加适量蒸馏水溶解,再加2mL6mol·L﹣1H2SO4,用0.2000mol·L﹣1KMnO4标准溶液滴定至终点时消耗18.00mL(尿素与KMnO4溶液不反应),则产品中CO(NH2)2·H2O2的质量分数为_____________;若滴定后俯视读数,则测得的过氧化尿素含量________(填“偏高”、“偏低”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应条件是影响有机化学反应的重要因素。下列各组物质的反应产物与反应条件无关的是
A. 甲苯与氯气 B. 丙烯与溴的CCl4溶液
C. 溴乙烷与氢氧化钠 D. 乙醇与浓硫酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质中,第一种是电解质,第二种是分散系,第三种是合金的是 ( )
A. 硫酸、CuSO4·5H2O、生铁 B. 酒精、空气、铜绿
C. 二氧化碳、明矾、熟石灰 D. 硝酸钾、食盐水、黄铜
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com