
| A. | 锌锰干电池工作一段时间后碳棒变细 | |
| B. | 在海轮外壳上镶入锌块可减缓船体的腐蚀,是采用了牺牲阳极的阴极保护法 | |
| C. | 铜锌原电池工作时,电子沿外电路从铜电极流向锌电极 | |
| D. | 电解MgCl2饱和溶液,可制得金属镁 |
分析 A.锌锰干电池中Zn为负极;
B.海轮外壳上镶入锌块,构成原电池时Zn为负极;
C.铜锌原电池工作时,Zn为负极,电子由负极流向正极;
D.电解MgCl2饱和溶液,氢离子在阴极放电,氯离子在阳极放电.
解答 解:A.锌锰干电池中Zn为负极,则工作一段时间后碳棒不变,故A错误;
B.海轮外壳上镶入锌块,构成原电池时Zn为负极,则可减缓船体的腐蚀,是采用了牺牲阳极的阴极保护法,故B正确;
C.铜锌原电池工作时,Zn为负极,电子沿外电路从锌电极流向铜电极,故C错误;
D.电解MgCl2饱和溶液,氢离子在阴极放电,氯离子在阳极放电,则生成氢氧化镁、氢气、氯气,应电解熔融氯化镁冶炼Mg,故D错误;
故选B.
点评 本题考查原电池及电解池,为高频考点,把握工作原理及电极反应为解答的关键,侧重分析与应用能力的考查,注意电化学知识的应用,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 原子半径Y>Z>X | |
| B. | X分别与Y、Z形成的化合物均至少有两种 | |
| C. | 最高价氧化物对应水化物的酸性:W>Z | |
| D. | 氢元素在与X、Y、Z分别形成的化合物中,化合价均为+1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
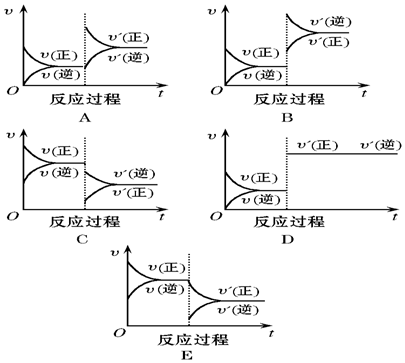
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在熔融状态下不导电的化合物都是非电解质 | |
| B. | 液氯是纯净物,氯水是混合物,均不属于电解质 | |
| C. | SO2溶于水能导电,所以SO2是电解质 | |
| D. | 硫酸溶于水可以导电,所以浓硫酸是电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 非金属性:Y>X>W | |
| B. | Z与W形成的化合物中存在共价键 | |
| C. | 一定条件下Z3Y2与水反应可生成M | |
| D. | 工业上用W单质与澄清石灰水反应制取漂白粉 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
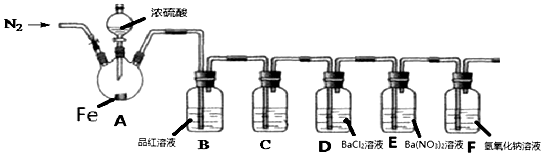
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.3 gNa+中含有NA个电子 | |
| B. | 硫酸的摩尔质量与硫酸分子的质量相等 | |
| C. | NA个CC14分子在标准状况下的体积约为22.4 L | |
| D. | 18 g H2O中含有NA个H2、NA个O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知A、B、C、D、E都是周期表中前四周期的元素,它们的原子序数依次增大.其中A元素原子的核外p电子数比s电子数少1.C是电负性最大的元素.D原子次外层电子数是最外层电子数2倍,E是第Ⅷ族中原子序数最小的元素.
已知A、B、C、D、E都是周期表中前四周期的元素,它们的原子序数依次增大.其中A元素原子的核外p电子数比s电子数少1.C是电负性最大的元素.D原子次外层电子数是最外层电子数2倍,E是第Ⅷ族中原子序数最小的元素.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com