
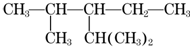
 ,该有机物系统命名是2,4-二甲基-3-乙基戊烷,1mol该烃完全燃烧需消耗氧气14mol,该烃一氯取代物有7种.
,该有机物系统命名是2,4-二甲基-3-乙基戊烷,1mol该烃完全燃烧需消耗氧气14mol,该烃一氯取代物有7种. 分析 根据烷烃的命名原则对该有机物进行命名;1molC9H20完全燃烧消耗氧气的物质的量为:(9+$\frac{20}{4}$)mol=14mol,分子中 有7种氢,所以一氯代物只有7种.
有7种氢,所以一氯代物只有7种.
解答 解:该有机物最长碳链含有5个C,主链为戊烷,编号从左下方开始,在2、4号C各含有1个甲基,3号碳上有一个乙基,该有机物命名为:2,4-二甲基-3-乙基戊烷,1molC9H20完全燃烧消耗氧气的物质的量为:(9+$\frac{20}{4}$)mol=14mol,分子中 有7种氢,所以一氯代物只有7种
有7种氢,所以一氯代物只有7种
故答案为:2,4-二甲基-3-乙基戊烷;14;7.
点评 本题考查了有机物的命名、有机燃烧的计算等知识,题目难度中等,注意掌握常见有机物的命名原则,根据烃燃烧的规律计算.


 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案科目:高中化学 来源: 题型:选择题
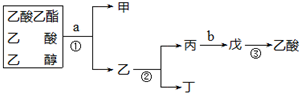
| A. | 甲是乙酸乙酯 | |
| B. | ①、②操作都是蒸馏 | |
| C. | a试剂是饱和Na2CO3溶液 | |
| D. | 制备乙酸乙酯时加试剂的顺序是:乙醇、浓硫酸、乙酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
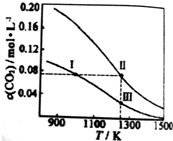
| A. | 反应CO2(g)+c(s)?2CO(g)△H<0 | |
| B. | 反应速率:V逆(状态Ⅰ)>V逆(状态Ⅲ) | |
| C. | 体系中c(CO):c(CO,状态Ⅱ)<2c(CO,状态Ⅲ) | |
| D. | 体系的压强:2P总(状态Ⅰ)>P总(状态Ⅱ)>P总(状态Ⅰ) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | x=4 | B. | 平衡向正反应方向移动 | ||
| C. | B的转化率降低 | D. | C的体积分数增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ②
② ③
③ ④
④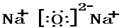 ⑤
⑤ ⑥
⑥ ⑦
⑦
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com