
科学家将两种元素铅和氪的原子核对撞,获得了一种质子数为118、质量数为293的超重元素,该元素原子核内的中子数与核外电子数之差为
| A.47 | B.57 |
| C.61 | D.175 |
 走进文言文系列答案
走进文言文系列答案科目:高中化学 来源: 题型:单选题
下列分子中,所有原子都满足最外层8电子稳定结构的是( )
| A.光气(COCl2) | B.六氟化硫(SF6) |
| C.三氟化硼(BF3) | D.五氯化磷(PCl5) |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
根据中学化学教材所附元素周期表判断,下列叙述正确的是( )
| A.由左至右第8、9、10三列元素中没有非金属元素 |
| B.第三、四、五、六周期元素的数目分别是18、18、32、32 |
| C.L电子层为奇数的所有元素都是非金属 |
| D.只有第ⅡA族元素的原子最外层有2个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
超铀元素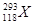 的发现是世界重大科技成果之一,它有力地支持了“稳定岛”(具有“魔数”数目的质子和中子的原子核的化学元素特别稳定)的假说,原子
的发现是世界重大科技成果之一,它有力地支持了“稳定岛”(具有“魔数”数目的质子和中子的原子核的化学元素特别稳定)的假说,原子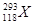 的中子数与核外电子数之差为
的中子数与核外电子数之差为
| A.0 | B.118 |
| C.57 | D.175 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(12分) X、Y、Z三种短周期元素,两两之间能组成5种化合物A、B、C、D、E;X、Y、Z三种元素可组成化合物F。已知:化合物A、B、C中原子个数比都为1︰1;B为淡黄色固体,C、E常温下均为无色液体;A是化学式为XZ的离子化合物,A与E反应生成F和一种气体;D是化学式为X2Y的离子化合物,D的阴、阳离子具有相同的电子层结构且与E分子所含电子数相等。 请回答下列问题:
(1)X元素的名称是________________。
(2)X、Y、Z的原子半径从大到小的顺序是(用元素符号表示)____________________。
(3)写出F的电子式______________________________。
(4)已知X单质、A、B、D固体,分别与E反应都生成同一种物质,其中X单质、A、B分别与E的反应均是氧化还原反应。请写出X单质、B分别与E反应的化学方程式___________, ;
B中含有的化学键是 ;请举一例说明B的用途_____________。
(5)请写出由化合物C制取Y的单质反应的化学方程式_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(9分)下表为元素周期表的一部分,a、b、c……为部分元素。回答下列问题:
| a | | | |||||||||||||||
| | | | | f | | h | i | | |||||||||
| | b | | e | | | | j | | |||||||||
| c | | | | | | | | d | | | | | g | | | k | |
| | | | | | | | | | | | | | | | | l | |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(15分)现有A、B、C、D、E、F、G、H八种短周期主族元素,原子序数依次增大。已知A与E、D与G分别同主族;E、F、G、H同周期;A分别与C、D可形成含有10个电子的共价化合物M、N;B的最外层电子数是其电子层数的2倍;D是地壳中含量最多的元素;F位于B的前一主族。请回答下列问题:
(1)元素B在周期表中的位置 ,M的空间构型是 。
(2)A、D、E三种元素组成一种常见化合物,W与该化合物的阴离子具有相同的原子种类和数目且不带电,W的电子式为 ,工业上利用某一个反应可同时生产该化合物和H的单质,写出该反应的化学方程式 。
(3)E、F元素的最高价氧化物对应的水化物之间反应的离子方程式 。
(4)M、N均能结合H+,其中结合H+能力较强的是 (填化学式)。N结合H+所形成的微粒中心原子采用 杂化。其键角比N中的键角大,原因为 。
(5)E分别与D、G形成摩尔质量相等的化合物X、Y,其中Y的水溶液显碱性的原因是
(用离子方程式表示)。常温下7.8 g X与水反应放出Q kJ热量(Q>0),写出该反应的热化学方程式 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com