
【题目】溶液、浊液、胶体三种分散系的本质区别为( )
A.稳定性B.透明度C.分散质粒子的直径大小D.颜色
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中一定能大量共存的是
A. 滴入酚酞显红色的溶液:Na+、NH4+、NO3-、Cl-
B. 0.1mol·L-1Fe(NO3)2溶液:H+、Al3+、SO42-、Cl-
C. 0.1mol·L-1氨水溶液:K+、Na+、NO3-、A1O2-
D. c(H+)/c(OH-)=1012mol·L-1的溶液:Ca2+、NH4+、Cl-、HCO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生设计了如下3个实验方案,用以检验淀粉的水解程度:
甲方案:淀粉液 ![]() 水解液
水解液 ![]() 中和液
中和液 ![]() 溶液变蓝
溶液变蓝
结论:淀粉尚未水解
乙方案:淀粉液 ![]() 水解液
水解液 ![]() 无银镜现象
无银镜现象
结论:淀粉尚未水解
丙方案:淀粉液 ![]() 水解液
水解液 ![]() 中和液
中和液 
结论:淀粉水解完全
上述三种方案操作是否正确 说明理由。上述三种方案结论是否正确 说明理由。 ______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2-甲基-2-己醇常用于合成洗涤剂、乳化剂等。实验室制备2-甲基-2-己醇的流程如下:
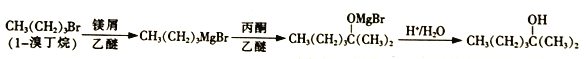
已知:RMgBr化学性质活泼,易与H2O、R'X等发生反应生成RH、R-R'。
(1)仪器A的名称是___________。
(2)引发CH3(CH2)3Br与镁屑反应可微热或加入米粒大小的碘单质,其中碘的作用可能是_____,若镁屑不足,则反应时生成的有机副产物为________(填结构简式)。

(3)干燥管中无水氯化钙的作用为__________。
(4)加入丙酮及稀硫酸时均需用冰水冷却,这是因为_________。
(5)起始加入三颈烧瓶的1-溴丁烷的体积为5mL,密度为1.28g/mL,最终所得产品的质量为2.71g,则2-甲基-2-己醇的产率为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】空气吹出法工艺是目前“海水提溴”的最主要方法之一,其工艺流程如图所示。

(1)“苦卤”到“含Br2的海水”过程____(填“是”或“不是”)氧化还原反应。
(2)步骤④利用了S02的还原性,反应的离子方程式为____。
(3)步骤⑥的蒸馏过程中,温度应控制在80~90℃。温度过高或过低都不利于生产,其原因是____。
(4)若处理1 m3海水需要消耗0.45 molSO2,不考虑转化过程中溴的损耗,则海水中溴离子的物质的量浓度为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某可逆反应:2A(g)![]() B(g)+D(g)在3种不同条件下进行,B和D的起始浓度均为0,反应物A的浓度随反应时间的变化情况如下表:
B(g)+D(g)在3种不同条件下进行,B和D的起始浓度均为0,反应物A的浓度随反应时间的变化情况如下表:
实验 序号 | 时间/min 浓度/molL-1 温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
1 | 800 | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 | 0.50 |
2 | 800 | 1.0 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 |
3 | 950 | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 | 0.20 |
(1)实验1中,在10~20 min内,以物质A表示的平均反应速率为____mol·L-1·min-l,50 min时,v(正)____(填“<”“>”或“=”)v(逆)。
(2)0~20 min内,实验2比实验1的反应速率_____(填“快”或“慢”),其原因可能是______。
(3)实验3比实验1的反应速率____(填“快”或“慢”),其原因是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】As2O3在医药、电子等领域有重要应用。某含砷元素(As)的工业废水经如图1流程转化为粗产品。

(1)“碱浸”的目的是将废水中的H3AsO3和H3AsO4转化为盐。H3AsO4转化为Na3AsO4反应的化学方程式是_______________________________。
(2)“氧化”时,1molAsO33-转化为AsO43-至少需要O2______ mol。
(3)“沉砷”是将砷元素转化为Ca5(AsO4)3OH沉淀,发生的主要反应有:
a.Ca(OH)2(s)![]() Ca2+(aq)+2OH-(aq) △H<0
Ca2+(aq)+2OH-(aq) △H<0
b.5Ca2++OH-+3AsO43-![]() Ca5(AsO4)3OH △H>0
Ca5(AsO4)3OH △H>0
研究表明:“沉砷”的最佳温度是85℃。 用化学平衡原理解释温度高于85℃后,随温度升高沉淀率下降的原因是_____________________。
(4)“还原”过程中H3AsO4转化为H3AsO3,反应的化学方程式是_______________________。
(5)“还原”后加热溶液,H3AsO3分解为As2O3,同时结晶得到粗As2O3。As2O3在不同温度和不同浓度硫酸中的溶解度(S)曲线如图2所示。为了提高粗As2O3的沉淀率,“结晶”过程进行的操作是_______。

(6)下列说法中,正确的是 ______ (填字母)。
a.粗As2O3中含有CaSO4
b.工业生产中,滤液2可循环使用,提高砷的回收率
c.通过先“沉砷”后“酸化”的顺序,可以达到富集砷元素的目的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在溶液导电性实验中,往氢氧化钡溶液中滴加硫酸至过量,灯泡的明亮度变化是:明→暗→明,下列说法正确的是()
A.溶液的导电性与溶液中离子的浓度有关
B.溶液的导电性与溶液中离子数目的多少有关
C.恰好完全反应时,溶液不易导电,所以BaSO4和水都是弱电解质
D.往氢氧化钡溶液中滴加盐酸与滴加硫酸时现象相同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com