
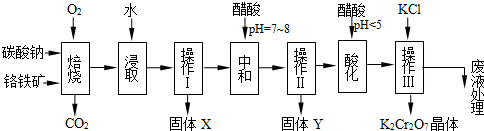
铬铁矿的主要成分可表示为FeO·Cr2O3,还含有SiO2、Al2O3等杂质,以铬铁矿为原料制备重铬酸钾(K2Cr2O7)的过程如下图所示。
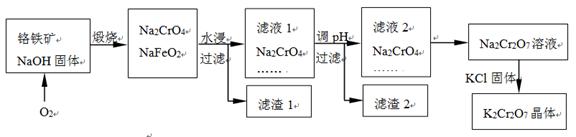
已知:① NaFeO2遇水强烈水解。 ② Cr2O72-+ H2O 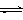 2CrO42- +
2H+
2CrO42- +
2H+
 K2Cr2O7中Cr元素的化合价是 。
K2Cr2O7中Cr元素的化合价是 。
生成滤渣1中红褐色物质反应的化学方程式是 。
滤液1的成分除Na2CrO4、Na2SiO3外,还含有(填化学式) 。
利用滤渣2,可制得两种氧化物,其中一种氧化物经电解冶炼可获得金属,该电解反应的化学方程式是 。
由滤液2转化为Na2Cr2O7溶液应采取的措施是 。
向Na2Cr2O7溶液中加入KCl固体,获得K2Cr2O7晶体的操作依次是:加热浓缩、 、过滤、洗涤、干燥。
煅烧铬铁矿生成Na2CrO4和NaFeO2反应的化学方程式是 。
+6 (1分) ;NaFeO2+2H2O→Fe(OH)3↓+NaOH; NaOH、NaAlO2
2Al2O3(熔融)  4Al + 3O2↑ 加硫酸酸化;冷却结晶 (1分)
4Al + 3O2↑ 加硫酸酸化;冷却结晶 (1分)
4FeO·Cr2O3 + 7O2 +
20NaOH 8Na2CrO4 + 4NaFeO2+
10H2O
8Na2CrO4 + 4NaFeO2+
10H2O
【解析】
试题分析:(1)根据化合物化合价的代数和为0可知,K2Cr2O7中Cr元素的化合价是+(2×7-1×2)÷2=+6价。
(2)由于NaFeO2遇水强烈水解,则生成滤渣1中红褐色物质反应的化学方程式是NaFeO2+2H2O→Fe(OH)3↓+NaOH。由于矿石中还含有氧化铝,且氢氧化钠是过量的,则滤液1的成分除Na2CrO4、Na2SiO3外,还含有NaOH、NaAlO2。
(3)由于滤液中含有偏铝酸钠,则可以制备氧化铝,电解熔融的氧化铝可以制备金属铝,反应的化学方程式是2Al2O3(熔融)  4Al + 3O2↑.
4Al + 3O2↑.
(4)根据方程式Cr2O72-+ H2O  2CrO42- +
2H+可知,由滤液2转化为Na2Cr2O7溶液应采取的措施是加硫酸酸化;获得K2Cr2O7晶体的操作依次是:加热浓缩、冷却结晶、过滤、洗涤、干燥。
2CrO42- +
2H+可知,由滤液2转化为Na2Cr2O7溶液应采取的措施是加硫酸酸化;获得K2Cr2O7晶体的操作依次是:加热浓缩、冷却结晶、过滤、洗涤、干燥。
(5)根据原子守恒可知,煅烧铬铁矿生成Na2CrO4和NaFeO2反应的化学方程式是4FeO·Cr2O3
+ 7O2 + 20NaOH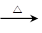 8Na2CrO4 + 4NaFeO2+
10H2O。
8Na2CrO4 + 4NaFeO2+
10H2O。
考点:考查化合价的判断、方程式的书写、反应条件的控制、基本实验操作等
点评:该题是高考中的常见题型,难度大,综合性强,对学生的要求高。试题在注重对基础知识巩固和训练的同时,侧重对学生能力的培养和解题方法的指导与训练,有利于培养学生规范严谨的实验设计能力以及评价能力。该类试题综合性强,理论和实践的联系紧密,有的还提供一些新的信息,这就要求学生必须认真、细致的审题,联系所学过的知识和技能,进行知识的类比、迁移、重组,全面细致的思考才能得出正确的结论。


 捷径训练检测卷系列答案
捷径训练检测卷系列答案 小夫子全能检测系列答案
小夫子全能检测系列答案科目:高中化学 来源:2012届上海市浦东新区高三下学期4月质量抽测化学试卷(带解析) 题型:填空题
(本题共12分)铬铁矿的主要成分可表示为FeO·Cr2O3,还含有MgO、Al2O3、Fe2O3等杂质,以下是以铬铁矿为原料制备重铬酸钾(K2Cr2O7)的流程图:
已知:①4FeO·Cr2O3+ 8Na2CO3+ 7O2 8Na2CrO4 + 2 Fe2O3 + 8CO2↑;
8Na2CrO4 + 2 Fe2O3 + 8CO2↑;
②Na2CO3 + Al2O3 2NaAlO2 + CO2↑;③ Cr2O72-+ H2O
2NaAlO2 + CO2↑;③ Cr2O72-+ H2O 2CrO42-+ 2H+
2CrO42-+ 2H+
根据题意回答下列问题:
1.固体X中主要含有_________(填写化学式);要检测酸化操作中溶液的pH是否等于4.5,应该使用__________(填写仪器或试剂名称)。
2.酸化步骤用醋酸调节溶液pH<5,其目的是_________________________________。
3.操作Ⅲ有多步组成,获得K2Cr2O7晶体的操作依次是:加入KCl固体、蒸发浓缩、 、过滤、_______、干燥。
4.下表是相关物质的溶解度数据,操作Ⅲ发生反应的化学方程式是:Na2Cr2O7+2KCl →K2Cr2O7↓+2NaCl。该反应在溶液中能发生的理由是_______________。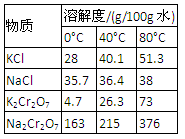
5.副产品Y主要含氢氧化铝,还含少量镁、铁的难溶化合物及可溶性杂质,精确分析Y中氢氧化铝含量的方法是称取n g样品,加入过量______(填写试剂)、溶解、过滤、再______(填写试剂)、……灼烧、冷却、称量,得干燥固体m g 。计算样品中氢氧化铝的质量分数为_________(用含m、n的代数式表示)。
6.六价铬有毒,而Cr3+相对安全。工业含铬(CrO3)废渣无害化处理的方法之一是干法解毒,用煤不完全燃烧生成的CO还原CrO3。在实验室中模拟这一过程的装置如下: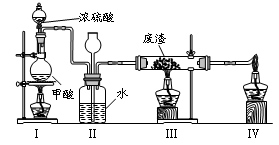
CO由甲酸脱水制得;实验结束时熄灭酒精灯的顺序是_________________________。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年江西省高三第四次模考化学试卷(解析版) 题型:填空题
铬铁矿的主要成分可表示为FeO·Cr2O3,还含有MgO、Al2O3、Fe2O3等杂质,以下是以铬铁矿为原料制备重铬酸钾(K2Cr2O7)的流程图:

已知:①4FeO·Cr2O3+ 8Na2CO3+
7O2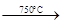 8Na2CrO4
+ 2 Fe2O3 + 8CO2↑;
8Na2CrO4
+ 2 Fe2O3 + 8CO2↑;
②Na2CO3
+ Al2O3 2NaAlO2
+ CO2↑;③ Cr2O72-+ H2O
2NaAlO2
+ CO2↑;③ Cr2O72-+ H2O 2CrO42- +
2H+
2CrO42- +
2H+
根据题意回答下列问题:
(1)固体X中主要含有_________(填写化学式);要检测酸化操作中溶液的pH是否等于4.5,应该使用__________(填写仪器或试剂名称)。
(2)酸化步骤用醋酸调节溶液pH<5,其目的是_________________________________。
(3)操作Ⅲ有多步组成,获得K2Cr2O7晶体的操作依次是:加入KCl固体、蒸发浓缩、 、过滤、_______、干燥。
(4)下表是相关物质的溶解度数据,操作Ⅲ发生反应的化学方程式是:Na2Cr2O7+2KCl → K2Cr2O7↓+2NaCl。该反应在溶液中能发生的理由是_______________。
|
物质 |
溶解度/(g/100g水) |
||
|
0°C |
40°C |
80°C |
|
|
KCl |
28 |
40.1 |
51.3 |
|
NaCl |
35.7 |
36.4 |
38 |
|
K2Cr2O7 |
4.7 |
26.3 |
73 |
|
Na2Cr2O7 |
163 |
215 |
376 |
(5)副产品Y主要含氢氧化铝,还含少量镁、铁的难溶化合物及可溶性杂质,精确分析Y中氢氧化铝含量是称取n g样品,加入过量______(填写试剂)、溶解、过滤、再______(填写试剂)、……灼烧、冷却、称量,得干燥固体m g 。计算样品中氢氧化铝的质量分数为_______(用含m、n的代数式表示)。
(6)六价铬有毒,而Cr3+相对安全。工业含铬(CrO3)废渣无害化处理的方法之一是干法解毒,用煤不完全燃烧生成的CO还原CrO3。在实验室中模拟这一过程的装置如下:
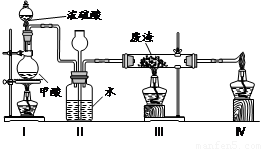
CO由甲酸脱水制得;实验结束时熄灭酒精灯的顺序是_________________________。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年四川省高三上学期第三次月考理综化学试卷(解析版) 题型:填空题
铬铁矿的主要成分可表示为FeO·Cr2O3,还含有MgO、Al2O3、Fe2O3等杂质,以下是以铬铁矿为原料制备重铬酸钾(K2Cr2O7)的流程图:
已知:①4FeO·Cr2O3+ 8Na2CO3+
7O2 8Na2CrO4
+ 2 Fe2O3 + 8CO2↑;
8Na2CrO4
+ 2 Fe2O3 + 8CO2↑;
②Na2CO3
+ Al2O3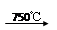 2NaAlO2
+ CO2↑;③ Cr2O72-+ H2O
2NaAlO2
+ CO2↑;③ Cr2O72-+ H2O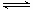 2CrO42- +
2H+
2CrO42- +
2H+
(1)固体X中主要含有_________(填写化学式);要检测酸化操作中溶液的pH是否等于4.5,应该使用__________(填写仪器或试剂名称)。
(2)酸化步骤用醋酸调节溶液pH<5,其目的是_________________________________。
|
物质 |
溶解度/(g/100g水) |
||
|
0°C |
40°C |
80°C |
|
|
KCl |
28 |
40.1 |
51.3 |
|
NaCl |
35.7 |
36.4 |
38 |
|
K2Cr2O7 |
4.7 |
26.3 |
73 |
|
Na2Cr2O7 |
163 |
215 |
376 |
(3)操作Ⅲ有多步组成,获得K2Cr2O7晶体的操作依次是:加入KCl固体、蒸发浓缩、 、
过滤、_______、干燥。
(4)右表是相关物质的溶解度数据,操作Ⅲ发生反应的化学方程式是:Na2Cr2O7+2KCl→K2Cr2O7↓+2NaCl。该反应在溶液中能发生的理由是_______________。
(5)酸性溶液中过氧化氢能使Cr2O72-生成蓝色的过氧化铬(CrO5分子结构为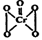 ),
该反应可用来检验Cr2O72-的存在。写出反应的离子方程式:
。
),
该反应可用来检验Cr2O72-的存在。写出反应的离子方程式:
。
该反应 (填“属于”或“不属于”)氧化还原反应。
(6)称取重铬酸钾试样2.500g配成250mL溶液,取出25mL与碘量瓶中,加入10mL2mol/ L H2SO4和足量碘化钾(铬的还原产物为Cr3+),放于暗处5min。然后加入100mL水,加入3mL淀粉指示剂,用0.1200mol/LNa2S2O3标准溶液滴定(I2+2S2O32—=2I-+S4O62—)。
①判断达到滴定终点的依据是 ;
②若实验中共用去Na2S2O3标准溶液40.00mL,则所得产品中重铬酸钾的纯度为 。(保留3位有效数字, K2Cr2O7的摩尔质量为294g/mol)。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年江西省南昌市高三第三次模拟考试理综化学试卷(解析版) 题型:计算题
铬铁矿的主要成分可表示为FeO·Cr2O3,还含有MgO、Al2O3、Fe2O3等杂质,以下是以铬铁矿为原料制备重铬酸钾(K2Cr2O7)的流程图:
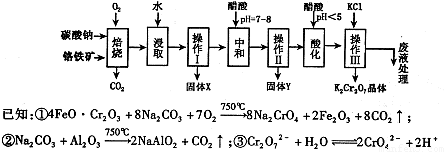
根据题意回答下列问题:
(1)固体X中主要含有 (填写化学式);要检测酸化操作中溶液的pH是否等于4.5,应该使用 (填写仪器或试剂名称)。
(2)酸化步骤用醋酸调节溶液pH <5,其目的是 。
(3)操作Ⅲ有多步组成,获得K2Cr2O7晶体的操作依次是:加入KCl固体、蒸发浓缩、
、过滤、 、干燥。
(4)下表是相关物质的溶解度数据,操作III发生反应的化学方程式是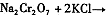
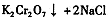 。该反应在溶液中能发生的理由是:
。
。该反应在溶液中能发生的理由是:
。

(5)副产品Y主要含氢氧化铝,还含少量镁、铁的难溶化合物及可溶性杂质,精确分析Y中氢氧化铝含量的方法是称取ng样品,加入过量 (填写试剂)、溶解、过滤、再加入过量 (填写试剂)、……灼烧、冷却、称量,得干燥固体mg。计算祥品中氢氧化铝的质量分数为 (用含m、n的代数式表示)。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年上海市浦东新区高三下学期4月质量抽测化学试卷(解析版) 题型:填空题
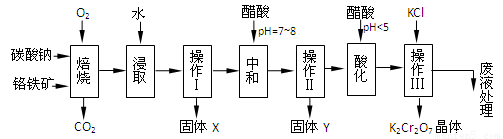
(本题共12分)铬铁矿的主要成分可表示为FeO·Cr2O3,还含有MgO、Al2O3、Fe2O3等杂质,以下是以铬铁矿为原料制备重铬酸钾(K2Cr2O7)的流程图:
已知:①4FeO·Cr2O3+ 8Na2CO3+ 7O2 8Na2CrO4
+ 2 Fe2O3 + 8CO2↑;
8Na2CrO4
+ 2 Fe2O3 + 8CO2↑;
②Na2CO3 + Al2O3 2NaAlO2
+ CO2↑;③ Cr2O72-+ H2O
2NaAlO2
+ CO2↑;③ Cr2O72-+ H2O 2CrO42- + 2H+
2CrO42- + 2H+
根据题意回答下列问题:
1.固体X中主要含有_________(填写化学式);要检测酸化操作中溶液的pH是否等于4.5,应该使用__________(填写仪器或试剂名称)。
2.酸化步骤用醋酸调节溶液pH<5,其目的是_________________________________。
3.操作Ⅲ有多步组成,获得K2Cr2O7晶体的操作依次是:加入KCl固体、蒸发浓缩、 、过滤、_______、干燥。
4.下表是相关物质的溶解度数据,操作Ⅲ发生反应的化学方程式是:Na2Cr2O7+2KCl → K2Cr2O7↓+2NaCl。该反应在溶液中能发生的理由是_______________。
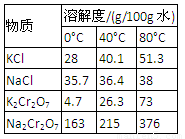
5.副产品Y主要含氢氧化铝,还含少量镁、铁的难溶化合物及可溶性杂质,精确分析Y中氢氧化铝含量的方法是称取n g样品,加入过量______(填写试剂)、溶解、过滤、再______(填写试剂)、……灼烧、冷却、称量,得干燥固体m g 。计算样品中氢氧化铝的质量分数为_________(用含m、n的代数式表示)。
6.六价铬有毒,而Cr3+相对安全。工业含铬(CrO3)废渣无害化处理的方法之一是干法解毒,用煤不完全燃烧生成的CO还原CrO3。在实验室中模拟这一过程的装置如下:
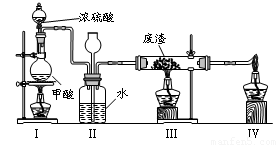
CO由甲酸脱水制得;实验结束时熄灭酒精灯的顺序是_________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com