
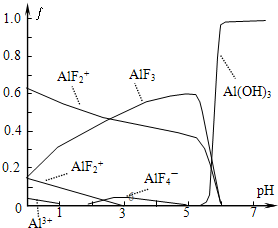
 氟和氟盐是化工原料.由于氟气性质活泼,很晚才制取出来.
氟和氟盐是化工原料.由于氟气性质活泼,很晚才制取出来.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
| A、用加热、称重的方法鉴别Na2CO3固体和NaHCO3固体 |
| B、用焰色反应鉴别NaCl固体和NaOH固体 |
| C、用KSCN溶液鉴别FeCl3溶液和Fe2(SO4)3溶液 |
| D、用丁达尔效应鉴别NaCl溶液和KCl溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、电解池的阴极上都是发生失电子的氧化反应 |
| B、用惰性电极电解Na2SO4溶液,阴、阳两极产物的物质的量之比为1:2 |
| C、用惰性电极电解饱和NaCl溶液,若有1 mol电子转移,则生成1molNaOH |
| D、酸、碱、盐溶液电解后pH都增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图所示表示的是电解饱和食盐水的装置,阴极材料是铁棒,阳极材料是碳棒,饱和食盐水中含有少量酚酞.
如图所示表示的是电解饱和食盐水的装置,阴极材料是铁棒,阳极材料是碳棒,饱和食盐水中含有少量酚酞.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、电解时,石墨作阳极,铁作阴极 |
| B、阴极的电极反应式为:2H++2e-═H2↑ |
| C、电解过程中阳极周围溶液的pH变大 |
| D、理论上每生成1mol KIO3则电路中流过6mol电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、配制硫酸溶液时,可先在量筒中加入一定体积的水,再在搅拌条件下慢慢加入浓硫酸 |
| B、浓硫酸沾到皮肤上时,可立即用大量水冲洗,然后涂上3%~5%的NaHCO3溶液 |
| C、酒精灯不慎碰倒起火时,可用湿抹布或沙子盖灭水扑灭,不能用水泼灭 |
| D、碱沾到皮肤上时,应立即用大量水冲洗,再涂上硼酸溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com