
【题目】下列离子方程式书写正确的是( )
A.向溴化亚铁溶液中通入过量氯气Fe2++2Br-+2Cl2=Fe3++Br2+4Cl-
B.三氯化铁溶液跟过量氨水反应Fe3++3NH3H2O=Fe(OH)3↓+3NH![]()
C.硫化亚铁与盐酸反应S2-+2H+=H2S↑
D.过量铁粉与稀HNO3反应Fe+4H++NO![]() =Fe3++NO↑+2H2O
=Fe3++NO↑+2H2O
【答案】B
【解析】
A. 此反应Fe2++2Br-+2Cl2=Fe3++Br2+4Cl-,电荷不守恒,根据化学式FeBr2,氯气过量,Fe2+、Br-应该完全反应,则符合题意的离子方程式为:2Fe2++4Br-+3Cl2=2Fe3++2Br2+3Cl-,A错误;
B. 三氯化铁溶液跟过量氨水反应,氨水为弱碱,生成的Fe(OH)3难溶于水,离子方程式Fe3++3NH3H2O=Fe(OH)3↓+3NH![]() ,B正确;
,B正确;
C. 硫化亚铁难溶于水,与盐酸反应时离子方程式为:FeS+2H+=Fe2++H2S↑,C错误;
D. 过量铁粉与稀HNO3反应生成二价铁,离子方程式为:3Fe+8H++2NO![]() =3Fe2++2NO↑+4H2O,D错误;
=3Fe2++2NO↑+4H2O,D错误;
答案选B。


科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是()
A.Ca(HCO3)2溶液与少量NaOH溶液反应:Ca2++2HCO3-+2OH-=CaCO3↓+CO32-+2H2O
B.用铜作电极电解食盐水:2Cl-+2H2O![]() 2OH-+H2↑+Cl2↑
2OH-+H2↑+Cl2↑
C.向氧化铁中加入氢碘酸:Fe2O3+6H+=2Fe3++3H2O
D.向一定量明矾溶液中滴加Ba(OH)2溶液至生成沉淀的物质的量最多:2Al3++3SO42-+3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物A是农药生产中的一种中间体,其结构简式如下图所示。下列叙述正确的是

A. 有机物A可与溴水发生加成反应
B. 1mol有机物A能消耗2molNaOH
C. 有机物A不能使酸性高锰酸钾溶液褪色
D. 有机物A分子中所有碳原子可能在同一平面上
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸盐与钴(Ⅲ)形成的一种配合物1Co(NH3)5NO2]Cl2的制备流程如下:
![]()
(1)Co2+基态核外电子排布式为 。
(2)配合物1Co(NH3)5Cl]Cl2中与Co3+形成配位键的原子为 (填元素符号);配离子 1Co(NH3)5NO2]2+的配体中氮原子的杂化轨道类型为 。
(3)与NO2-互为等电子体的单质分子为 (写化学式)。
(4)H2O2与H2O可以任意比例互溶,除因为它们都是极性分子外,还因为 。
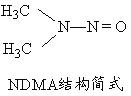
(5)亚硝酸盐在水体中可转化为强致癌物亚硝胺,亚硝胺NDMA的结构简式如图所示,1molNDMA分子中含有![]() 键的数目为 mol。
键的数目为 mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上采用硫铁矿焙烧去硫后的烧渣(主要成分为Fe2O3、FeO、SiO2、Al2O3,不考虑其他杂质) 制取七水合硫酸亚铁(FeSO4·7H2O) ,流程如下:

(1)浸取时,溶液中的Fe2+易被空气中的O2氧化,其离子方程式为 。能提高烧渣浸取速率的措施有 (填字母)。
A.将烧渣粉碎 B.降低硫酸的浓度 C.适当升高温度
(2)还原时,试剂X的用量与溶液pH的变化如图所示,则试剂X可能是 (填字母)。

A.Fe粉 B.SO2 C.NaI
还原结束时,溶液中的主要阴离子有 。
(3)滤渣Ⅱ主要成分的化学式为 ;由分离出滤渣Ⅱ后的溶液得到产品,进行的操作是 、 过滤、洗涤、干燥。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W为原子序数依次增大的短周期元素,其中W原子的质子数是其M层电子数的三倍,Z与W、X与Y相邻,X与W同主族。下列说法不正确的是( )
A.原子半径:W>Z>Y>X
B.最高价氧化物对应水化物的酸性:X>W>Z
C.最简单气态氢化物的热稳定性:Y>X>W>Z
D.元素X、Z、W的最高化合价分别与其主族序数相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,请参照元素①-⑧在表中的位置,用化学用语回答下列问题:
族 周期 | IA | 0 | ||||||
1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
2 | ② | ③ | ④ | |||||
3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
(1)⑧的原子结构示意图为_________;
(2)②的气态氢化物分子的结构式为___________,②和⑦的气态氢化物的稳定性相比,其中较弱的是____ (用该氢化物的化学式表示);
(3)②、③的最高价含氧酸的酸性由强到弱的顺序是____(填化学式);
(4)⑤、⑥元素的金属性强弱依次为___________(填“增大”、“减小”或“不变”);
(5)④、⑤、⑥的形成的简单离子半径依次_________(填“增大”、“减小”或“不变”);
(6)①、④、⑤元素可形成既含离子键又含共价键的化合物,写出它的电子式:_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com