
| A. | 只有①②④⑤ | B. | 全部 | C. | 只有①② | D. | 只有①②③④ |
分析 ①氢元素属于非金属元素;
②非金属元素的单质在反应中可以做氧化剂也可以做还原剂;
③碳酸、亚硫酸以及硅酸等均是弱酸;
④水在常温下是液态;
⑤二氧化氮可以和水反应生成一氧化氮和硝酸.
解答 解:①氢元素属于非金属元素,是主族元素,原子的最外层电子数为1,小于3,故①错误;
②非金属元素的单质在反应中可以做氧化剂也可以做还原剂,比如氯气和水的反应中,氯气既是氧化剂又是还原剂,故②错误;
③C、S、Si对应的含氧酸分别为碳酸、亚硫酸、硅酸,均是弱酸,故③错误;
④氢元素的氢化物是水,水在常温下是液态,不是气态,故④错误;
⑤气态氧化物二氧化氮可以和水反应生成一氧化氮气体和硝酸,故⑤错误.
故选B.
点评 本题主要考查学生对非金属元素以及其化合物的掌握,要求学生熟记教材知识,学以致用,难度不大.


 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 17gOH-中所含电子数为10NA | |
| B. | Na2O2固体中的阳离子和阴离子个数比是1:1 | |
| C. | 9g重水(${\;}_{1}^{2}$D2O)所含有的电子数为5NA | |
| D. | 在标准状况下,11.2L氖气含有NA个氖原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 负极反应式为Mg-2e-=Mg2+ | |
| B. | 电池放电时Cl-由正极向负极迁移 | |
| C. | 正极反应式为Ag++e-=Ag | |
| D. | 负极会发生副反应Mg+2H2O=Mg(OH)2+H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| J | ||||
| R |
 ;
;| 选项 | a | b | c | d |
| x | 温度 | 温度 | 加入H2的物质的量 | 加入甲的物质的量 |
| y | 甲的物质的量 | 平衡常数K | 甲的转化率 | 生成物物质的量总和 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2和SO2 | B. | Ca(OH)2和Cu(OH)2 | C. | H2SO4和H3PO4 | D. | ZnSO4和CuSO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
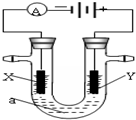 电解原理在化学工业中有广泛应用.下图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液.请回答以下问题:
电解原理在化学工业中有广泛应用.下图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液.请回答以下问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com