
| 操作 | 步骤及现象 |
 | i:往溶液中缓慢通入SO2,液面上方有红棕色气体,溶液黄色无明显变化 ii:继续通入足量的SO2,溶液变为深棕色,一段 时间后,溶液变为浅绿色 |
分析 (1)亚铁离子水解,破坏水的电离平衡,使溶液呈酸性;
(2)①硝酸具有强氧化性,将亚铁离子氧化为铁离子,自身被还原生成NO,NO与氧气反应生成二氧化氮;
②铁离子遇KSCN溶液显红色;
③稀硝酸中亚铁离子被氧化为铁离子,使生成[Fe(NO)]2+的平衡逆向移动,最终完全氧化为铁离子;
(3)①往溶液中缓慢通入SO2,液面上方有红棕色气体,溶液黄色无明显变化,说明硝酸将二氧化硫氧化为硫酸;
②溶液上方产生红棕色的气体,说明硝酸根被还原,溶液没有深棕色出现,说明铁离子没有被还原为亚铁离子;
③溶液变为浅绿色,说明硝酸根反应完毕,铁离子氧化二氧化硫,而被还原为亚铁离子;
④氧化剂的氧化性强于氧化产物的氧化性,还原剂的还原性强于还原产物的还原性.
解答 解:(1)亚铁离子水解:Fe2++2H2O?Fe(OH)2+2H+,破坏水的电离平衡,使溶液呈酸性,
故答案为:Fe2++2H2O?Fe(OH)2+2H+;
(2)①硝酸具有强氧化性,将亚铁离子氧化为铁离子,自身被还原生成NO,NO与氧气反应生成二氧化氮,
故答案为:NO2;
②检验Fe3+的操作是:取少量黄色溶液于试管中,滴入KSCN溶液,溶液显红色,证明含有Fe3+,
故答案为:取少量黄色溶液于试管中,滴入KSCN溶液,溶液显红色,证明含有Fe3+;
③最初溶液中生成[Fe(NO)]2+使溶液呈深棕色,最终溶液变黄色的原因是:在稀硝酸中Fe2+被NO3-氧化为Fe3+,使c(Fe2+)降低,Fe2++NO?〔Fe(NO)]2+的平衡向左移动,当Fe2+被完全氧化为Fe3+时,溶液由深棕色变为黄色,
故答案为:在稀硝酸中Fe2+被NO3-氧化为Fe3+,使c(Fe2+)降低,Fe2++NO?〔Fe(NO)]2+的平衡向左移动,当Fe2+被完全氧化为Fe3+时,溶液由深棕色变为黄色;
(3)①往溶液中缓慢通入SO2,液面上方有红棕色气体,溶液黄色无明显变化,说明硝酸将二氧化硫氧化为硫酸,反应离子方程式为:2NO3-+3SO2+2H2O=3SO42-+2NO↑+4H+,
故答案为:2NO3-+3SO2+2H2O=3SO42-+2NO↑+4H+;
②溶液上方产生红棕色的气体,说明NO3-被还原,溶液没有深棕色出现,说明Fe2+没有被氧化为Fe3+,该同学的说法正确,
故答案为:正确,溶液上方产生红棕色的气体,说明NO3-被还原,溶液没有深棕色出现,说明Fe2+没有被氧化为Fe3+;
③溶液变为浅绿色,说明硝酸根反应完毕,铁离子氧化二氧化硫,而被还原为亚铁离子,反应离子方程式为:2Fe3++SO2+2H2O=2Fe2++SO42-+4H+,
故答案为:2Fe3++SO2+2H2O=2Fe2++SO42-+4H+;
④由发生的氧化还原反应可知,该实验得出的结论是:SO2的还原性比Fe2+的强,
故答案为:SO2的还原性比Fe2+的强.
点评 本题考查物质性质探究实验,侧重考查学生对原理分析理解,熟练掌握元素化合物性质,是对学生综合能力的考查,题目难度中等.


科目:高中化学 来源: 题型:解答题
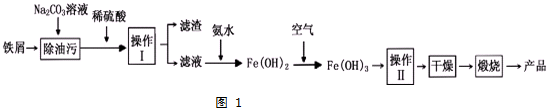
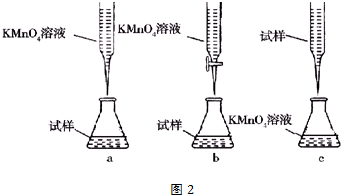
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2014年德美科学家因开发超分辨率荧光显微镜获诺贝尔化学奖,使光学显微镜分辨率步入了纳米时代.利用此类光学显微镜可以观察活细胞内蛋白质等大分子 | |
| B. | 熟石膏与水混合成糊状后会很快凝固,转化为坚硬的生石膏,可用它制作石膏绷带 | |
| C. | 蚕丝、过氧化氢酶、核酸充分水解后均可得到α氨基酸 | |
| D. | 氢键在形成蛋白质二级结构和DNA双螺旋结构中起关键作用 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
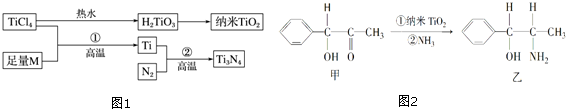
| I1 | I2 | I3 | I4 | I5 | |
| 电离能/kJ•mol-1 | 738 | 1 451 | 7 733 | 10 540 | 13 630 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
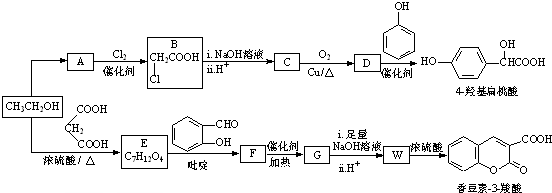
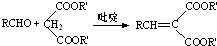 (R,R′,R″表示氢、烷基或芳基)
(R,R′,R″表示氢、烷基或芳基)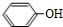 $\stackrel{催化剂}{→}$
$\stackrel{催化剂}{→}$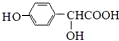 .
. $\stackrel{吡啶}{→}$
$\stackrel{吡啶}{→}$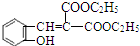 +H2O.
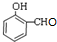
+H2O.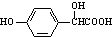 )的同分异构体
)的同分异构体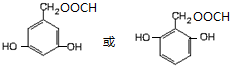 .
.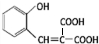 $\stackrel{浓硫酸}{→}$
$\stackrel{浓硫酸}{→}$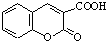 +H2O.
+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 熔点/℃ | 沸点/℃ | 备注 | |
| 白磷 | 44 | 280.5 | |
| PH3 | -133.8 | -87.8 | 难溶于水,具有还原性 |
| SiF4 | -90 | -86 | 易水解 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
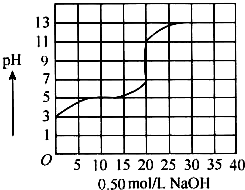 在100mL盐酸的溶液中,以0.50mol/L氢氧化钠溶液滴定后得滴定曲线如图所示,下列叙述正确的是( )
在100mL盐酸的溶液中,以0.50mol/L氢氧化钠溶液滴定后得滴定曲线如图所示,下列叙述正确的是( )| A. | 盐酸在滴定前的浓度是0.3mol/L | |
| B. | 该盐酸稀释10倍后pH为4 | |
| C. | 滴定过程为求滴定终点,指示剂只能用酚酞 | |
| D. | 若用酚酞作指示剂,滴定终点时溶液颜色的变化为红色到无色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2015年中国诺贝尔生理学奖获奖者屠呦呦女士用乙醚从黄花蒿中提取青蒿素,该技术应用了分馏原理 | |
| B. | 绿色化学的核心是应用化学原理对环境污染进行治理 | |
| C. | 生物炼铜原理是利用某些具有特殊本领的细菌把不溶性的硫化铜转化为铜单质 | |
| D. | 近日我国科学家成功制得反应物--超快正电子,正电子与负电子相遇就会湮灭并释放出极大的能量 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com