
| A. | υ(A)=1.5 mol•L-1•s-1 | B. | υ(B)=0.5 mol•L-1•s-1 | ||
| C. | υ(C)=0.8 mol•L-1•s-1 | D. | υ(D)=1 mol•L-1•s-1 |
分析 由于不同物质表示的熟练之比等于其化学计量数之比,故反应速率的单位相同时,化学反应速率与其化学计量数的比值越大,则反应速率越快,注意保持单位一致.
解答 解:由于不同物质表示的熟练之比等于其化学计量数之比,故反应速率的单位相同时,化学反应速率与其化学计量数的比值越大,则反应速率越快.
A.因为反应物A是固体,不能用浓度变化来表示反应速率;
B.v=v(B)=0.5mol/(L•s);
C.v=$\frac{1}{3}$v(C)=0.27mol/(L•s);
D.v=$\frac{1}{4}$v(D)=0.25mol/(L•s);所以反应速率v(B)>v(C)>v(D),
故选B.
点评 比较反应速率常用的两种方法:(1)归一法:将同一反应中的不同物质的反应速率转化成同一物质的反应速率,再较小比较.(2)比值法:用各物质的量表示的反应速率除以对应各物质的化学计量数,数值大的反应速率快.


科目:高中化学 来源: 题型:选择题
| 选项 | 类比对象 | 结论 |
| A | 2F2+2H2O═4HF+O2 | 2I2+H2O═4HI+O2↑ |
| B | C+2CuO$\frac{\underline{\;高温\;}}{\;}$2Cu+CO2↑ | 3C+2Fe2O3$\frac{\underline{\;高温\;}}{\;}$4Fe+3CO2↑ |
| C | Na2O+H2O═2NaOH | FeO+H2O═Fe(OH)2 |
| D | Ca(ClO)2+CO2+H2O═CaCO3↓+2HClO | Ca(ClO)2+SO2+H2O═CaSO3↓+2HClO |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子式为C4H8的有机物可能存在4个C-C单键 | |
| B. | 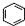 、 、 和 和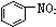 均属于芳香烃 均属于芳香烃 | |
| C. | 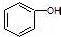 和 和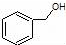 分子组成相差一个-CH2-,因此是同系物关系 分子组成相差一个-CH2-,因此是同系物关系 | |
| D. | 结构简式为C2H5-OH的核磁共振氢谱上有2个吸收峰 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
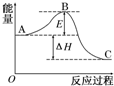 2SO2(g)+O2(g)?2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3的△H=-99 kJ•mol-1.请回答下列问题:
2SO2(g)+O2(g)?2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3的△H=-99 kJ•mol-1.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2(g)+$\frac{1}{2}$ O2(g)═H2O(g)△H=+242 kJ/mol | B. | 2H2(g)+O2(g)═2H2O(l)△H=-484kJ/mol | ||
| C. | H2(g)+$\frac{1}{2}$ O2(g)═H2O(g)△H=-242kJ/mol | D. | 2H2(g)+O2(g)═2H2O(g)△H=+484 kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
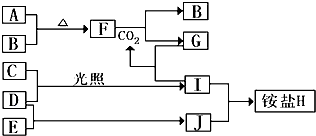
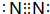 和
和 .
.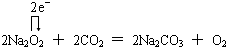 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.067mol | B. | 0.02mol | C. | 0.03mol | D. | 0.04mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com