
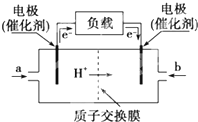
 如图是某公司批量生产的笔记本电脑所用的甲醇燃料电池的构造示意图.甲醇在催化剂作用下提供质子(H+)和电子,电子经过电路、质子经内电路到达另一极与氧气反应,该电池总反应式为:2CH3OH+3O2═2CO2+4H2O.下列有关该电池的说法错误的是( )
如图是某公司批量生产的笔记本电脑所用的甲醇燃料电池的构造示意图.甲醇在催化剂作用下提供质子(H+)和电子,电子经过电路、质子经内电路到达另一极与氧气反应,该电池总反应式为:2CH3OH+3O2═2CO2+4H2O.下列有关该电池的说法错误的是( )| A、右边的电极为电池的负极,b处通入的是空气 |
| B、左边的电极为电池的负极,a处通入的是甲醇 |
| C、电池负极的反应式为:2CH3OH+2H2O-12e-═2CO2↑+12H+ |
| D、电池正极的反应式为:3O2+12H++12e-═6H2O |


 新课标同步训练系列答案
新课标同步训练系列答案 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案 小学学习好帮手系列答案
小学学习好帮手系列答案科目:高中化学 来源: 题型:
| A、两途径最终达到平衡时,体系内混合气的平均相对分子质量不同 | ||
| B、两途径最终达到平衡时,体系内混合气的百分组成相同 | ||
| C、达平衡时,途径Ⅰ的反应速率v(A)小于途径Ⅱ的反应速率v(A) | ||
D、达平衡时,途径Ⅰ所得混合气的密度为途径Ⅱ所得混合气密度的
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验序号 | 甲 | 乙 | 丙 |
| 合金质量/mg | 510 | 770 | 918 |
| 气体体积/mL | 560 | 672 | 672 |
| A、甲组和乙组的实验中,盐酸均是过量的 |
| B、盐酸的物质的量浓度为0.8mol/L |
| C、合金中镁铝的物质的量之比为1:1 |
| D、丙组中铝的物质的量为0.018mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、若在恒温恒压下,当x=1时,按1.5 mol A、1 mol C作为起始物质,达到平衡后,C的体积分数仍为a |
| B、若在恒温恒容下,当x=2时,将2molC作起始物质,达到平衡后,C的体积分数仍为a |
| C、若在恒温恒压下,当x=3时,1mol A、1mol B、6mol C作起始物质,达到平衡后,C的体积分数仍为a |
| D、若在恒温恒容下,按0.6mol A、0.3mol B、1.4mol C作起始物质,达到平衡后,C的体积分数仍为a,则x一定为2或3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、4mol SO2+2mol O2 |
| B、1mol SO2+1mol O2 |
| C、1mol SO2+1mol O2+1mol SO3 |
| D、1mol SO2+0.5mol O2+1mol SO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
| A、平衡向逆反应方向移动 |
| B、x+y>z |
| C、B的物质的量增大 |
| D、C的体积分数保持不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com