
| A. | “水玻璃”长期暴露在空气中会变质,这是因为“水玻璃”与空气中的二氧化碳接触,生成 了乳白色的凝胶状沉淀(用H2SiO3表示)和碳酸钠的缘故 | |
| B. | 水的物理性质十分特殊.水的比热容较大,水结成冰后密度变小,水的熔沸点较高等特殊 性质是由于水分子间存在一种被称为氢键的特殊的分子间作用力 | |
| C. | 铅蓄电池是最常见的二次电池,由于它的性能优良、价格低廉、安全可靠,可多次充放电,所以使用广泛,但铅蓄电池也存在比能量低,废弃电池污染环境等缺点 | |
| D. | 硅晶体是一种重要的半导体材料,在常温下,单质硅易与氧气反应,所以自然界中不存在 游离态的硅.石墨烯作为目前发现的最薄、强度最大、导电导热性能最强的一种新型纳米材 料,最有潜力的应用是成为硅的替代品,用来生产未来的超级计算机 |
分析 A.碳酸酸性强于硅酸,依据强酸制备弱酸规律解答;
B.氢键为分子间作用力,氢键的存在影响物质的物理性质;
C.依据铅蓄电池优点结合铅蓄电池的比能量较低解答;
D.常温下硅与氧气不反应.
解答 解:A.碳酸酸性强于硅酸,“水玻璃”即硅酸钠水溶液与空气中的二氧化碳接触,反应生成硅酸白色沉淀和碳酸钠而变质,故A正确;
B.水分子中氧元素电负性强,所以容易形成氢键,在固态水(冰)中,水分子大范围地以氢键互相联结,形成相当疏松的晶体,从而在结构中有许多空隙,造成体积膨胀,密度减小,氢键的存在导致分子间作用力增强,所以其熔沸点较高,故B正确;
C.铅蓄电池是最常见的二次电池,由于它的性能优良、价格低廉、安全可靠,可多次充放电,所以使用广泛,但铅蓄电池也存在比能量低,废弃电池污染环境等缺点,故C正确;
D.常温下硅与氧气不反应,故D错误;
故选:D.
点评 本题考查了物质的组成与性质,熟悉强酸制备弱酸规律、明确氢键对物质物理性质的影响、硅的性质、铅蓄电池优缺点是解题关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
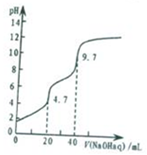 常温下,用0.1000mol•L-1 NaOH溶液滴定20mL0.1000mol•L-1 H3PO4溶液,滴定曲线如图所示,下列说法错误的是( )
常温下,用0.1000mol•L-1 NaOH溶液滴定20mL0.1000mol•L-1 H3PO4溶液,滴定曲线如图所示,下列说法错误的是( )| A. | NaH2PO4溶液呈酸性 | |
| B. | pH=9.7处,c(Na+)>c(HPO42-)>c(OH-)>c(H+) | |
| C. | pH=4.7处,c(Na+)=c(H2PO4-)+c(HPO42-)+c(PO43-) | |
| D. | 当2<pH<4.7时,H3PO4的第一步电离平衡常数均相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | S$→_{点燃}^{O_{2}}$SO3$\stackrel{H_{2}O}{→}$ H2SO4 | |
| B. | Fe $→_{点燃}^{Cl_{2}}$ FeCl2$\stackrel{NaOH溶液}{→}$ Fe(OH)2 | |
| C. | AlCl3(溶液)$\stackrel{蒸发}{→}$ AlCl3$\stackrel{电解}{→}$ Al | |
| D. | NaCl(饱和溶液)$\stackrel{依次通入NH_{3}、CO_{2}}{→}$ NaHCO3$\stackrel{△}{→}$Na2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 早在1 000多年前,我国就已采用加热胆矾(CuSO4•5H2O)或绿矾(FeSO4•7H2O) 的方法制硫酸,尽管硫酸的生产工艺几经改进,此方法仍然是工业生产硫酸的主要方法 | |
| B. | 氢能是未来能源结构中最具发展潜力的清洁能源之一.目前已有专家研究出用淀粉或纤维素与水在酶作用下转变为二氧化碳和氢气的方法制氢气.从整个循环来看,利用该方法得到的氢能来源于太阳能 | |
| C. | 在现代化学工业中催化剂的应用十分普遍,对于给定条件下反应物之间能够同时发生多个反应时,理想催化剂还可以大幅度提高目标产物在最终产物中的比率 | |
| D. | 有机反应中的加聚反应符合绿色化学的原则 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 若a>b,一定存在c(A-)=c(K+) | B. | 若a=2b,一定存在c(A-)>c(K+) | ||
| C. | 若2a=b,一定存在c(OH-)>c(A-) | D. | 若a=b,一定存在c(OH-)=c(H+)+c(HA) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;分子N中含有2个手性碳原子.
;分子N中含有2个手性碳原子.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com