
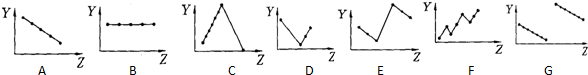
分析 Ⅰ、(1)ⅡA族元素的价电子数为2,随核电荷数增大,价电子数不变.
(2)第三周期元素的最高化合价,随核电荷数增大,最高化合价由+1价递增到+7,最后以稀有气体0价结束.
(3)电子层结构相同,核电荷数越大,离子半径越小,最外层电子数相同,电子层越多,离子半径越大.
(4)同周期主族元素,随原子序数递增原子半径减小.
(5)碱金属,随核电荷数增大,单质的还原性增强,阳离子的氧化性减弱.
II、(1)最外层电子数≤周期数为金属元素,最外层电子数>周期数为非金属元素;
(2)第VⅢ位于周期表第8、9、10纵行;
(3)Ti位于第四周期第IIIB族.
解答 解:Ⅰ、(1)ⅡA族元素的价电子数为2,随核电荷数增大,价电子数不变,故图B符合.
故选:B.
(2)第三周期元素的最高化合价,随核电荷数增大,最高化合价由+1价递增到+7,最后以稀有气体0价结束,故图C符合.
故选:C.
(3)电子层结构相同,核电荷数越大,离子半径越小,所以离子半径Na+>Mg2+>Al3+、P3->S2->Cl-,最外层电子数相同,电子层越多,离子半径越大,所以离子半径Cl->Na+.所以离子半径P3->S2->Cl->Na+>Mg2+>Al3+,故图E符合.
故选:E.
(4)同周期主族元素,随原子序数递增原子半径减小,故图G符合.
故选:G.
(5)碱金属,随核电荷数增大,单质的还原性增强,阳离子的氧化性减弱,故图A符合.
故选:A.
II、(1)最外层电子数≤周期数为金属元素,最外层电子数>周期数为非金属性元素;
(2)第VⅢ位于周期表第8、9、10纵行;
(3)Ti位于第四周期第ⅢB族,即第四周期第3纵行;
则画出图象为: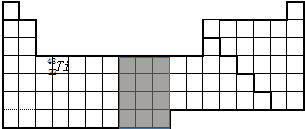 ;
;
故答案为: .
.
点评 本题考查元素周期律、原子结构与性质递变规律、元素周期表的结构等,难度不大,注意规律的归纳与总结与理解.


科目:高中化学 来源: 题型:解答题
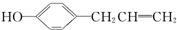
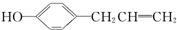 +NaOH→
+NaOH→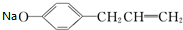 +H2O;
+H2O;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 聚丙烯的结构简式为: | B. | 氯化氢的电子式为: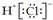 | ||
| C. | 甲烷的比例模型: | D. | 质量数为35的氯原子:${\;}_{35}^{17}$Cl |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题

| A. | 香芹酮化学式为C9H12O | |
| B. | Cyrneine A可以发生加成反应、消去反应和氧化反应 | |
| C. | 香芹酮和Cyrneine A均能使酸性KMnO4溶液褪色 | |
| D. | 与香芹酮互为同分异构体,分子中有4种不同化学环境的氢原子的酚类化合物共有4种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ④ | ⑤ | ⑥ | ⑧ | ⑩ | |||
| 3 | ① | ⑦ | ⑨ | |||||
| 4 | ② | ③ |
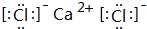 ,化学键类型为离子键(“离子键”或“共价键”).
,化学键类型为离子键(“离子键”或“共价键”).查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 试剂添加的顺序为硫酸一乙醇一乙酸 | |
| B. | 无论怎样控制反应条件,1mol乙酸与1mol乙醇反应都不会生成1mol乙酸乙酯 | |
| C. | 试管B中盛有饱和氢氧化钠溶液来除去乙酸乙酯中的杂质,反应后可用分液方法分离 | |
| D. | 生成的乙酸乙酯和硬脂酸甘油酯互为同系物,都可以发生水解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
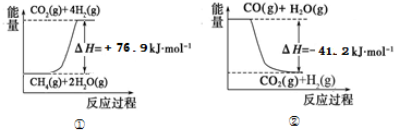
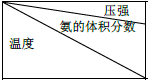 | 15.2MPa | 20.3MPa | 30.4MPa |
| 400℃ | 32.8% | 38.8% | 48.2% |
| 450℃ | 22.4% | 27.5% | 35.9% |
| 500℃ | 14.9% | 18.8% | 25.8 |
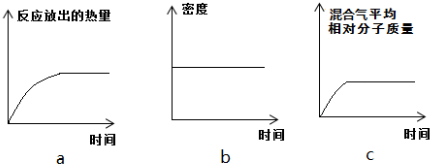
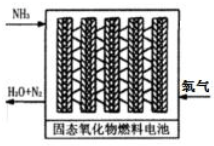
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com