
工业上制备纯硅反应的热化学方程式如下:SiCl4(g)+2H2(g)⇌Si(g)+4HCl(g);△H=+Q kJ•mol﹣1(Q>0),某温度、压强下,将一定量反应物通入密闭容器进行以上反应,下列叙述 正确的是()
正确的是()
A. 反应过程中,若增大压强能提高SiCl4的转化率
B. 若反应开始时SiCl4为1mol,则达平衡时,吸收热量为Q kJ
C. 反应至4min时,若HCl浓度为0.24 mol/L,则H2的反应速率为0.03 mol/(L•min)
D. 当反应吸收热量为0.025Q kJ时,生成的HCl通入100mL 1mol•L﹣1的NaOH溶液恰好反应
考点: 化学平衡的影响因素;有关反应热的计算;化学平衡的计算.
专题: 化学反应中的能量变化;化学平衡专题.
分析: A.增大平衡向气体体积减小的方向移动,据此判断;
B.该反应为可逆反应,1molSiCl4不能完全转化,结合热化学方程式判断;
C.根据v= 计算v(HCl),利用速率之比等于化学计量数之比计算判断;
计算v(HCl),利用速率之比等于化学计量数之比计算判断;
D.根据反应吸收的热量计算生成的HCl的物质的量,据此判断.
解答: 解:A.从方程式可以看出,反应物气体的计量数之和小于生成物气体的计量数之和,则增大压强,平衡向逆反应方向移动,SiCl4的转化率减小,故A错误;
B.该反应为可逆反应,1molSiCl4不能完全转化,达平衡时,吸收热量小于QkJ,故B错误;
C.反应至4min时,若HCl浓度为0.12mol/L,则v(HCl)=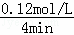 =0.03mol/(L•min),根据反应速率之比等于化学计量数之比,则v(H2)=
=0.03mol/(L•min),根据反应速率之比等于化学计量数之比,则v(H2)=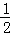 ×v(HCl)=
×v(HCl)=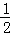 ×0.03mol/(L•min)=0.015mol/(L•min),故C错误;
×0.03mol/(L•min)=0.015mol/(L•min),故C错误;
D.由方程式可知,当反应吸收热量为0.025 QkJ时,生成HCl的物质的量为:
QkJ时,生成HCl的物质的量为: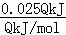 =0.1mol,100mL1mol/L的NaOH的物质的量为0.1L×1mol/L=0.1mol,二者物质的量相等,恰好反应,故D正确;
=0.1mol,100mL1mol/L的NaOH的物质的量为0.1L×1mol/L=0.1mol,二者物质的量相等,恰好反应,故D正确;
故选D.
点评: 本题考查较为综合,涉及反应热的计算、化学反应速率、化学平衡等问题,题目难度中等,注意反应的可逆性.


科目:高中化学 来源: 题型:
蓄电池在放电时起原电池作用,在充电时起电解池的作用.下式是爱迪生蓄电池分别在充电和放电时的反应:Fe+NiO2+2H2O Fe(OH)2+Ni(OH)2则下列有关对爱迪生蓄电池的推断错误的是( )
Fe(OH)2+Ni(OH)2则下列有关对爱迪生蓄电池的推断错误的是( )
|
| A. | 放电时正极附近pH增大 |
|
| B. | 充电时阴极的电极反应式为:Fe(OH)2+2e﹣═Fe+2OH﹣ |
|
| C. | 放电时电解质溶液中的阴离子向正极方向移动 |
|
| D. | 蓄电池的电极可浸入某种碱性电解质溶液中 |
查看答案和解析>>
科目:高中化学 来源: 题型:
已知多硫化钠Na2Sx(x≥2)在碱性溶液中可被NaClO氧化为Na2SO4,而NaClO被还原为NaCl,反应中Na2Sx与NaClO的物质的量之比为1:10,则x值是()
A. 2 B. 3 C. 4 D. 5
查看答案和解析>>
科目:高中化学 来源: 题型:
下列与化学反应能量变化相关的叙述正确的是()
A. 生成物总能量一定低于反应物总能量
B. 放热反应的反应速率总是大于吸热反应的反应速率
C. 应用盖斯定律,可计算某些难以直接测量的反应焓变
D. 同温同压下,H2(g)+Cl2(g)═2HCl(g)在光照和点燃条件下的△H不同
查看答案和解析>>
科目:高中化学 来源: 题型:
某同学组装了如图所示的电化学装置,电极Ⅰ为Al,其它均为Cu,则()

A. 电流方向:电极Ⅳ→A→电极Ⅰ
B. 电极Ⅰ发生还原反应
C. 电极Ⅱ逐渐溶解
D. 电极Ⅲ的电极反应:Cu2++2e﹣═Cu
查看答案和解析>>
科目:高中化学 来源: 题型:
反应A(g)⇌B(g)+C(g)在容积为1.0L的密闭容器中进行,A的初始浓度为0.050mol/L.温度T1和T2下A的浓度与时间关系如右图所示.回答下列问题:
(1)上述反应的温度T1小于 T2,平衡常数K(T1) K(T2).(填“大于”、“小于”或“等于”)
(2)若温度T2时,5min后反应达到平衡,A的转化率为70%,则:
①平衡时体系总的物质的量为 .
②反应的平衡常数K= .
③反应在0~5min区间的平均反应速率v(A)= .
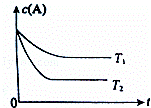
查看答案和解析>>
科目:高中化学 来源: 题型:
已知反应A2(g)+2B2(g)⇌2AB2(g)△H<0,下列说法正确的是()
A. 升高温度,正反应速率增大,逆反应速率减小
B. 增大压强可增大单位体积内活化分子的百分数,从而使有效碰撞次数增大
C. 达到平衡后,升高温度或减小压强平衡都向逆反应方向移动
D. 使用催化剂,可以改变活化能,从而改变反应的△H
查看答案和解析>>
科目:高中化学 来源: 题型:
判断下列有关化学基本概念的依据正确的是( )
|
| A. | 置换反应:是否有单质参加 |
|
| B. | 纯净物与混合物:是否仅含有一种元素 |
|
| C. | 溶液与胶体:本质区别是分散质粒子的直径大小 |
|
| D. | 电解质与非电解质:物质本身是否具有导电性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关电解精炼铜的说法中错误的是()
A. 粗铜做正极
B. 电解一段时间后,溶液中会存在锌、铁等不活泼的金属阳离子
C. 阳极泥中含有金、银等贵重金属
D. 电解质溶液可以选用硫酸铜溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com