
 电导率可用于衡量电解质溶液导电能力大小.室温下,用0.100mol/LNH3?H2O滴定10.00mL浓度均为0.100mol/L HCl和CH3COOH的混合溶液,所得曲线如图所示.下列说法正确的是( )
电导率可用于衡量电解质溶液导电能力大小.室温下,用0.100mol/LNH3?H2O滴定10.00mL浓度均为0.100mol/L HCl和CH3COOH的混合溶液,所得曲线如图所示.下列说法正确的是( )

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
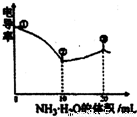
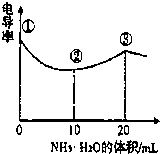 (2013?杭州一模)电导率可用于衡量电解质溶液导电能力大小,且电导率越大溶液的导电能力越强.室温下,用0.100mol?L-1的NH3?H2O 滴定10.00mL 浓度均为0.100mol?L-1HCl和CH3COOH的混合液,电导率曲线如图所示.下列说法正确的是( )
(2013?杭州一模)电导率可用于衡量电解质溶液导电能力大小,且电导率越大溶液的导电能力越强.室温下,用0.100mol?L-1的NH3?H2O 滴定10.00mL 浓度均为0.100mol?L-1HCl和CH3COOH的混合液,电导率曲线如图所示.下列说法正确的是( )查看答案和解析>>
科目:高中化学 来源: 题型:
电导率可用于衡量电解质溶液导电能力大小。室温下,用0.100滴定 10.00 mL 浓度均为 0.100 mol/L HCl和CH3COOH的混合溶液,所得曲线如右图所示。下列说法正确的是()
A. ①点溶液中C(H+)为
B. 溶液温度高低为①〉③〉②
C. ③点溶液中有
D. ③点后因离子数目减少使溶液电导率略降低
查看答案和解析>>
科目:高中化学 来源:2011-2012学年安徽省江南十校高三素质教育联考理科综合试卷化学部分(解析版) 题型:选择题
电导率可用于衡量电解质溶液导电能力大小。室温下,用0.100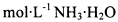 滴定 10.00 mL 浓度均为 0.100 mol/L HCl和CH3COOH的混合溶液,所得曲线如右图所示。下列说法正确的是()
滴定 10.00 mL 浓度均为 0.100 mol/L HCl和CH3COOH的混合溶液,所得曲线如右图所示。下列说法正确的是()
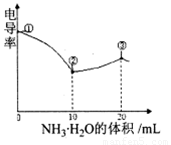
A. ①点溶液中C(H+)为
B. 溶液温度高低为①〉③〉②
C. ③点溶液中有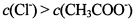
D. ③点后因离子数目减少使溶液电导率略降低
查看答案和解析>>
科目:高中化学 来源:2012-2013学年广西南宁二中高三(上)期中化学试卷(解析版) 题型:选择题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com