
| A. | CuO+2HCl═CuCl2+H2O | B. | 2Na2O2+2H2O═4NaOH+O2↑ | ||
| C. | Zn+CuSO4═ZnSO4+Cu | D. | Ca(OH)2+CO2═CaCO3↓+H2O |
科目:高中化学 来源: 题型:解答题
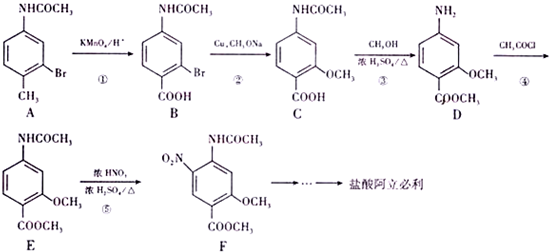
 .
.
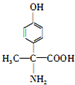
 (该物质易被氧化).请写出以
(该物质易被氧化).请写出以 、CH3COCl、CH3OH为原料制备
、CH3COCl、CH3OH为原料制备 的合成路线流程图(无机试剂任用).合成路线流程图示例如下:CH3CH2OH$→_{170℃}^{浓硫酸}$H2C═CH2$\stackrel{Hr_{2}}{→}$
的合成路线流程图(无机试剂任用).合成路线流程图示例如下:CH3CH2OH$→_{170℃}^{浓硫酸}$H2C═CH2$\stackrel{Hr_{2}}{→}$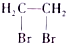
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 蒸馏、过滤、分液、蒸发 | B. | 蒸馏、蒸发、分液、过滤 | ||
| C. | 分液、过滤、蒸馏、蒸发 | D. | 过滤、蒸发、分液、蒸馏 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2 为 0.6mol/L、N2 为 0.2mol/L | B. | NH3为 0.25mol/L | ||
| C. | N2、NH3 均为 0.15mol/L | D. | NH3为 0.4mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳原子的骨架分类方法一般用于烃的分类 | |
| B. | 五个碳原子的环状化合物肯定是脂环化合物 | |
| C. | 不含苯环的碳环化合物都属于脂环化合物 | |
| D. | 芳香化合物就是指苯及苯的同系物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | CH3CH3+Cl2$\stackrel{光照}{→}$CH3CH2Cl+HCl CH2=CH2+HCl→CH3CH2Cl | 均为取代反应 |
| B | 由油脂得到甘油;由卤代烃制醇 | 均发生了水解反应 |
| C | Cl2+2Br?→2Cl?+Br2;Zn+Cu2+→Zn2++Cu | 均为单质被还原的置换反应 |
| D | 2Na2O2+2H2O→4NaOH+O2↑; 2F2+2H2O→4HF+O2 | 均为水作还原剂的氧化还原反应 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
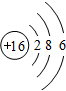 ,
,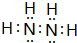
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
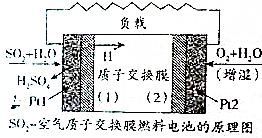 二氧化硫、空气质子交换膜电池将化学能默认变成电能的同时,实现了制硫酸、发电、环保三位一体的结合,降低了成本提高了效益,其原理如图所示,下列说法错误的是( )
二氧化硫、空气质子交换膜电池将化学能默认变成电能的同时,实现了制硫酸、发电、环保三位一体的结合,降低了成本提高了效益,其原理如图所示,下列说法错误的是( )| A. | Pt1电极附近发生的反应为SO2+2H2O-2e-═SO42-+4H+ | |
| B. | Pt2电极附近发生的反应为O2+4e-═2O2- | |
| C. | 该电池放电时电子从Pt1电极经过外电路流到Pt2电极 | |
| D. | 相同条件下,放电过程中消耗的SO2和O2的体积之比为2:1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com