
分析 (1)若C是一种碱性气体,常用作制冷剂,判断C为氨气,实验室是利用氯化铵和氢氧化钙加热反应制备氨气;
(2)若A为非金属固态单质,C、D均为气体且都能使澄清石灰水变浑浊,C、D分别为CO2、SO2中的一种,C、D均为气体且都能使澄清石灰水变浑浊且C能使溴水褪色,证明C为二氧化硫,D为二氧化碳,则该反应为碳与浓硫酸反应;
(3)若A为紫红色金属,则A为Cu,D为有色气体,该反应为Cu与浓硝酸反应.
解答 解:(1)若C是一种碱性气体,常用作制冷剂,判断C为氨气,实验室是利用氯化铵和氢氧化钙加热反应制备氨气,反应的化学方程式:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O,
故答案为:NH3,2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O;
(2)若A为非金属固态单质,C、D均为气体且都能使澄清石灰水变浑浊,C、D分别为CO2、SO2中的一种,C、D均为气体且都能使澄清石灰水变浑浊且C能使溴水褪色证明C为二氧化硫,D为二氧化碳,则该反应为碳与浓硫酸反应,故A为C,反应化学方程式为:C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O,C与溴水反应是二氧化硫和溴单质反应生成溴化氢和硫酸,反应的化学方程式为:SO2+Br2+2H2O=H2SO4+2HBr,
故答案为:C,SO2+Br2+2H2O=H2SO4+2HBr;
(3)若A为紫红色金属,则A为Cu,D为有色气体,该反应为Cu与浓硝酸反应(Cu+4H++2NO3-=Cu2++2H2O+2NO2↑),则D与水反应的离子方程式为H2O+3NO2=2H++2NO3-+NO,故答案为:Cu;H2O+3NO2=2H++2NO3-+NO.
点评 本题考查无机物的推断,为高频考点,综合考查元素化合物知识,把握反应、现象推断物质为解答的关键,侧重分析与推断能力的考查,注意物质的颜色、用途及物质类别等,题目难度不大.


科目:高中化学 来源: 题型:选择题
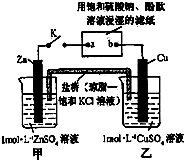
| A. | 片刻后可观察到滤纸a点变红色 | B. | 电子沿Zn→a→b→Cu路径流动 | ||
| C. | 片刻后甲池中c(SO42-)增大 | D. | 盐桥中的Cl-向Cu极移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 496 kJ•mol-1 | B. | 431 kJ•mol-1 | C. | 862 kJ•mol-1 | D. | 248 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
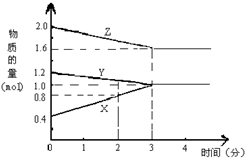 某温度时,在2L密闭容器中,X、Y、Z三种气态物质的物质的量随时间变化的曲线如图所示.由图中数据分析:
某温度时,在2L密闭容器中,X、Y、Z三种气态物质的物质的量随时间变化的曲线如图所示.由图中数据分析:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 键 | N-H | N-N | O=O | N≡N | H-O |
| 键能/kJ•mol-1 | 391 | 193 | 497 | 946 | 463 |
| A. | 1088 kJ•mol-1 | B. | 544 kJ•mol-1 | C. | 790 kJ•mol-1 | D. | 382 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ①③⑤ | C. | ①②⑤ | D. | ①②⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com