
 ����N2��H2����ʵ��NH3�Ĺ�ҵ�ϳɣ������ֿ��Խ�һ���Ʊ����ᣬ�ڹ�ҵ��һ��ɽ���������������ش��������⣺
����N2��H2����ʵ��NH3�Ĺ�ҵ�ϳɣ������ֿ��Խ�һ���Ʊ����ᣬ�ڹ�ҵ��һ��ɽ���������������ش��������⣺| t/K | 298 | 398 | 498 | �� |
| K/��mol•L-1��2 | 4.1��106 | K1 | K2 | �� |
���� ��1��������֪�Ȼ�ѧ����ʽ��˹���ɼ��㣬�ɸ�˹���ɢ١�2-�ڡ�2+�ۡ�3�õõ���Ӧ���ʱ䣬д����Ӧ��Ӧ���Ȼ�ѧ����ʽ��
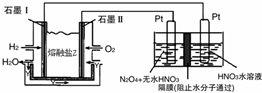
��2��ȼ��ԭ����У�������ȼ��ʧ���ӷ���������Ӧ��������ȼ��ʧ���Ӻ�̼������ӷ�Ӧ���ɶ�����̼��ˮ���ȸ��ݻ��ϼ��ж�����N2O5�ĵ缫��N2O5�е�Ԫ�صĻ��ϼ���+5�ۣ��������е�Ԫ��Ҳ��+5�ۣ����Ӧ�����������N2O5�����������������ɣ��ٸ������ӵķŵ�˳��д���缫��Ӧʽ��
��3���ö��Ե缫��ⱥ��NaCl��Һʱ��CH3OH-6e-+8OH-=CO32-+6H2O��ÿ����0.2mol CH3OH��ת�Ƶ���1.2mol�������缫��ӦΪ2H++2e-=H2��������ת��Ϊ1.2mol����Ӧ���������ʵ���Ϊ0.6mol���ݴ˼����״��������������
��4���ٸ����ʱ��ж������ﷴӦ��Ũ�ȵı仯��Ȼ�����ƽ�ⳣ���жϣ�
�ڸ���ƽ��״̬���ж������жϣ�
��5���ٸ������ӻ����������ˮ����Һ�����ԣ�ˮ��ԭ����NH4Cl���ƣ���N2H62+ˮ����H2O�������ɵ�OH-��
���������µĻ�ѧʽΪN2H6Cl2��ˮ��ʹ��Һ����������������Ũ�ȵĴ�С��ϵ��
��� �⣺��1��N2��g��+O2��g���T2NO��g����H=+180.5kJ/mol ��
N2��g��+3H2��g���T2NH3��g����H=-92.4kJ/mol ��
2H2��g��+O2��g���T2H2O��g����H=-483.6kJ/mol ��
�ɸ�˹���ɢ١�2-�ڡ�2+�ۡ�3�ã�4NH3��g��+5O2��g���T4NO��g��+6H2O��g����H=905.0kJ/mol��
�ʴ�Ϊ��4NH3��g��+5O2��g��=4NO��g��+6H2O��g����H=-905.0kJ/mol��
��2��ȼ��ԭ����У�������ȼ��ʧ���Ӻ�̼������ӷ�Ӧ���ɶ�����̼��ˮ���缫��ӦʽΪH2+CO32--2e-=CO2+H2O��
N2O5�е�Ԫ�صĻ��ϼ���+5�ۣ��������е�Ԫ��Ҳ��+5�ۣ����Ӧ�����������N2O5�����������������ɣ��ݵ缫��Ӧ���ӷŵ�˳���֪����������2H++2e-=H2���ķ�Ӧ��������ΪN2O4+2HNO3-2e-=2N2O5+2H+��
�ʴ�Ϊ��H2+CO32--2e-=CO2+H2O��N2O4+2HNO3-2e-=2N2O5+2H+��
��3���øõ������Դ���ö��Ե缫��ⱥ��NaCl��Һʱ��CH3OH-6e-+8OH-=CO32-+6H2O��ÿ����0.2mol CH3OH��ת�Ƶ���1.2mol�������缫��ӦΪ2H++2e-=H2���������������������=0.6mol��22.4L/mol=13.44L��
�ʴ�Ϊ��13.44��
��4���ٸ÷�Ӧ����Ӧ�Ƿ��ȷ�Ӧ�������¶ȣ�ƽ�����淴Ӧ�����ƶ���������Ũ�ȼ�С����Ӧ��Ũ����������K1��K2���ʴ�Ϊ������
��A����ͬ���ʵ����淴Ӧ����֮�ȵ����������֮����ƽ��״̬����֤�����淴Ӧ������ȣ���A��ȷ��
B����ͬ���ʵ����淴Ӧ����֮�ȵ����������֮����ƽ��״̬��2v��N2��������=v��H2�����棩����ƽ��״̬����B����
C��������ѹǿ���䣬��������ʵ������䣬�÷�Ӧ��ƽ��״̬����C��ȷ��
D����������ܱ������з�Ӧ���������䣬������䣬�ܶ�ʼ�ղ��䣬��D����
��ѡ��AC��
��5������ˮ����NH4Cl���ƣ���N2H62+ˮ����H2O�������ɵ�OH-����ˮ�����ӷ�ӦΪN2H62++H2O?[N2H5•H2O]++H+��
�ʴ�Ϊ��N2H62++H2O?[N2H5•H2O]++H+��
��2��A���������µĻ�ѧʽΪN2H6Cl2����c��Cl-����c��N2H62+������ˮ�������ԣ���c��H+����c��OH-������ˮ��ij̶Ⱥ�������c��N2H62+����c��H+����������Ũ�ȵĴ�С��ϵΪc��Cl-����c��N2H62+����c��H+����c��OH-������A����
B����ˮ�ⷽ��ʽN2H62++H2O?[N2H5•H2O]++H+����?[N2H5•H2O]+�����Խ����ٴ�ˮ�⣬��֪c��[N2H5•H2O+]����c��H+������B����
C�����ݵ���غ�ɵã�2c��N2H62+��+c��[N2H5•H2O+]��+c��H+��=c��Cl-��+c��OH-������C��ȷ��
D������A��֪��ȻD����D����
�ʴ�Ϊ��ABD��
���� ������Ҫ�����˸�˹���ɡ����صĹ���ԭ��֪ʶ��ԭ���ԭ����������㣬�Ѷ��еȣ�����ݻ��ϼ۵ı仯ȷ������N2O5�ĵ缫���������ӵķŵ�˳��д����Ӧ�ĵ缫��Ӧʽ�����ջ����ǹؼ���



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ���������Ʊ�Ư�� | B�� | ���ʹ�����������ά | ||
| C�� | ����������ˮ | D�� | ȼúʱ����ʯ��ʯ����SO2�ŷ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ͬλ�أ�14C��14N | |
| B�� | ͬϵ����顢�춡�顢������ | |
| C�� | ����ʣ������ᡢˮ�����ռ� | |
| D�� | ���������һ�������p������̼���������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �������ƵĻ�ѧʽ��Na2O | |
| B�� | �Ȼ��ƻ�ѧʽ��CaCl | |
| C�� | ����ԭ�ӽṹʾ��ͼ��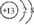 | |
| D�� | �����Ƶĵ��뷽��ʽ��Na2SO4�T2Na++SO42- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ����208 kJ������ | B�� | �ų�208 kJ������ | ||
| C�� | ����93 kJ������ | D�� | �ų�93 kJ������ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��֪X��һ��������ת��ΪY��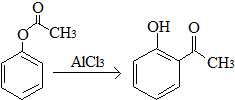 ��X��Y��Ϊͬ���칹�壬����FeCl3��Һ���� ��X��Y��Ϊͬ���칹�壬����FeCl3��Һ���� | |
| B�� | 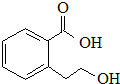 �ܷ����ķ�Ӧ�����У��ӳɷ�Ӧ��ȡ����Ӧ����ȥ��Ӧ��ˮ�ⷴӦ �ܷ����ķ�Ӧ�����У��ӳɷ�Ӧ��ȡ����Ӧ����ȥ��Ӧ��ˮ�ⷴӦ | |
| C�� | ���ۡ����������յ�ˮ����ﶼֻ��һ�� | |
| D�� | �����ʷ۾��п��������ܣ��ṹΪ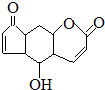 ������ˮ������Ӧ��1mol�������3molBr2������NaOH��Һ��Ӧ��1mol�������2molNaOH ������ˮ������Ӧ��1mol�������3molBr2������NaOH��Һ��Ӧ��1mol�������2molNaOH |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �״��е���ʯ����Һ�ʺ�ɫ | B�� | �״��붹�����г������� | ||
| C�� | pH ��ֽ��ʾ�״� pH Ϊ 2��3 | D�� | ���ǽ����ڰ״���������ų� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | C6H6 | B�� | ������ | C�� | H2CO3 | D�� | CH3Cl |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com