
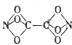
 某学生利用C、N、0三种原子拼接成了一种新型分子TetranitiBtoxycarbon(结构如图所示),科学家经过研究发现,这种分子具有良好的贮能特性,一旦被合成完全可用于制造新的炸药.下列有关说法正确的是( )
某学生利用C、N、0三种原子拼接成了一种新型分子TetranitiBtoxycarbon(结构如图所示),科学家经过研究发现,这种分子具有良好的贮能特性,一旦被合成完全可用于制造新的炸药.下列有关说法正确的是( )| A、该分子的分子式为CNO3 |
| B、分子中既含极性键又含非极性键 |
| C、C、N的化合价分别为+4、+3 |
| D、C、N、0的第一电离能依次增大 |


科目:高中化学 来源: 题型:
| A、两项 | B、三项 | C、四项 | D、五项 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、① | B、② | C、③ | D、④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、大理石溶于盐酸中:CO32-+2H+=CO2↑+H2O |
| B、氯化铝加到过量氢氧化钠溶液中:Al3++4OH-=[Al(OH)4]- |
| C、(NH4)2CO3溶液中加入过量Ba(OH)2溶液:NH4++OH-=NH3↑+H2O |
| D、氯化铁溶液中加入铜片:Fe3++Cu=Fe2++Cu2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验步骤 | 预期现象和结论 |
| 步骤1:取1mLA溶液于一试管中,加入约2mL的CCl4,充分振荡后静置. | |
| 步骤2: |
查看答案和解析>>
科目:高中化学 来源: 题型:
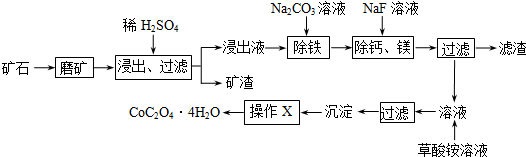

| c(Ca2+) |
| c(Mg2+) |
| 充电 |
| 放电 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验编号 | 镁的质量 | 镁的规格 | 盐酸的体积 | 盐酸的浓度 | 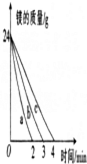 |
| ① | 24g | 镁条 | 500mL | 6mol?L-1 | |
| ② | 24g | 24g镁条 剪成100段 | 500mL | 6mol?L-1 | |
| ③ | 24g | 镁粉 | 500mL | 6mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com